Elektros srovės šaltiniai
Veikiausiai jau neįsivaizduojame kasdienybės be išmaniųjų telefonų, tranzistorinių radijo imtuvų, žibintuvėlių, dulkes siurbiančių robotų, elektromobilių. Visi šie daiktai turi baterijas – elektros srovės šaltinius, kurie gali būti maži kaip piršto nagas arba dideli kaip automobilio bagažinė. Gyvenimas be baterijų nublokštų mus dviem šimtmečiais atgal, kai šių elektros srovės šaltinių dar nebuvo. Kas ir kaip jas išrado?
Nuo varlės link elektros srovės šaltinio
Prieš daugiau kaip du šimtmečius tyrėjai aiškinosi, kaip dirba žmogaus ir gyvūnų raumenys, kodėl jie susitraukia ir atsipalaiduoja (2.2.1 pav., a).

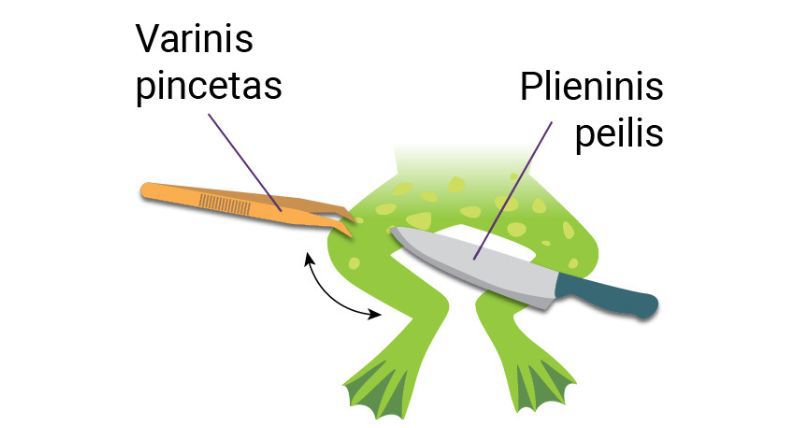
1786 m. italų anatomas ir fiziologas Luidžis Galvanis (Luigi Galvani, 1737–1798) tyrinėjo žaibavimo įtaką negyvos varlės kojų raumenų darbui. Preparuotos varlės koją jis pamirkė druskos tirpale ir pakabino ant varinio kabliuko prie geležinės tvorelės. Lauke nežaibavo, tačiau pūtė stiprokas vėjas. Papūtus vėjo gūsiui varlės koja, pakabinta ant varinio kabliuko, susvyravo ir palietė geležinės tvoros virpstą. Palietusi jį koja sutrūkčiojo. Taip tyrėjas suprato, kad žaibas neturi įtakos varlės kojos raumenų susitraukimui. Tęsdamas bandymus L. Galvanis išsiaiškino, kad varlės koja sutrūkčioja, paliesta dviem iš skirtingų metalų pagamintais įrankiais (2.2.1 pav., b). Vis dėlto jam nepavyko paaiškinti, kodėl taip nutinka. L. Galvanis manė, kad koja sutrūkčioja varlei išleidžiant „gyvūninę elektrą“.
Pirmasis elektros srovės šaltinis – Voltos stulpas
L. Galvanio tyrimais susidomėjo to meto fizikai, chemikai ir gydytojai. Tęsdamas jo bandymus italų fizikas A. Volta įsitikino, kad varlės koja sutrūkčioja ne dėl vadinamosios gyvūninės kilmės elektros. A. Volta suprato, kad elektros srovė atsiranda tarp dviejų plokštelių, pagamintų iš skirtingų metalų ir panardintų į skystį, kuriuo gali tekėti elektros srovė. Kitaip tariant, varlės koja niekuo dėta, vietoj jos galėtų būti obuolys, bulvė ar citrina (2.2.2 pav.).
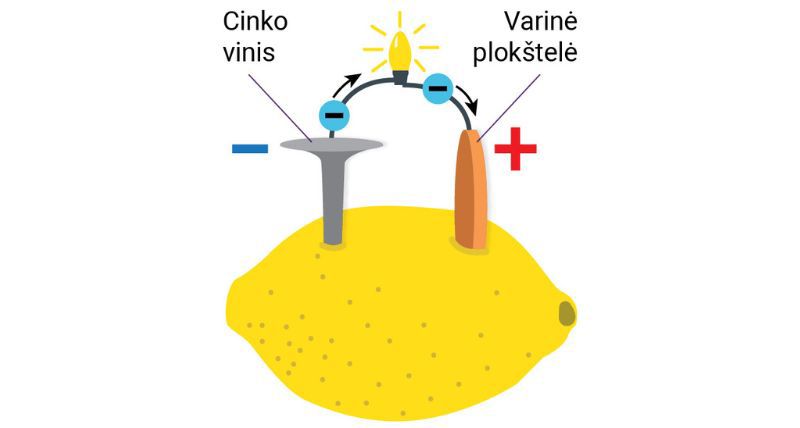
A. Volta atliko bandymą su dviem skirtingų metalų monetomis, sujungtomis vielute. Vieną monetą jis pasikišo po liežuviu, o kitą užsidėjo ant jo. Dėl pratekėjusios elektros srovės tyrėjas burnoje pajuto rūgštoką skonį. Vadinasi, iš skirtingų metalų pagamintos monetos ir liežuvis veikė kaip elektros srovės šaltinis.
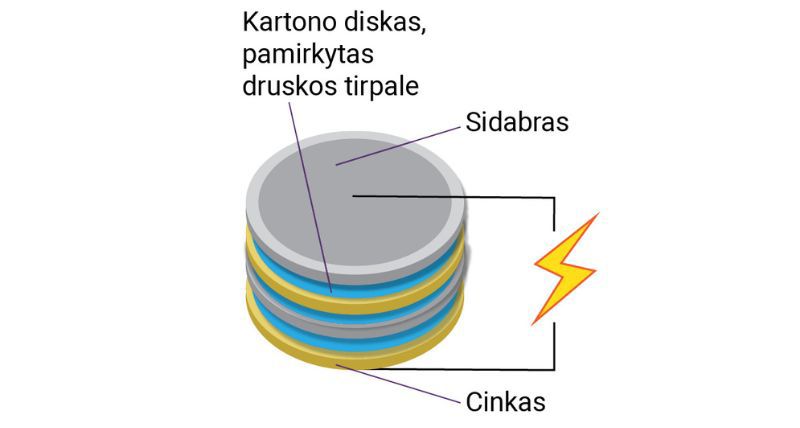
Po ilgų bandymų, 1800 m., A. Volta sukūrė pirmąjį nuolatinės elektros srovės šaltinį (toliau – elektros srovės šaltinis). Aptarkime, kaip jis tai padarė. Tyrėjas paėmė kelias cinko ir sidabro plokšteles ir atskyrė jas vieną nuo kitos kartono diskais, pamirkytais druskos tirpale (2.2.3 pav., a). Tuomet prie viršutinės ir apatinės metalo plokštelių pritvirtino laidus. Taip sumuštinio principu buvo sukurtas pirmasis pasaulyje elektros srovės šaltinis – Voltos stulpas (2.2.3 pav., b). Nors šių dienų elektros srovės šaltiniai (2.2.4 pav., a) atrodo kitaip nei Voltos stulpas, jų sandara ir veikimo principas panašus.
Galvaninis elementas
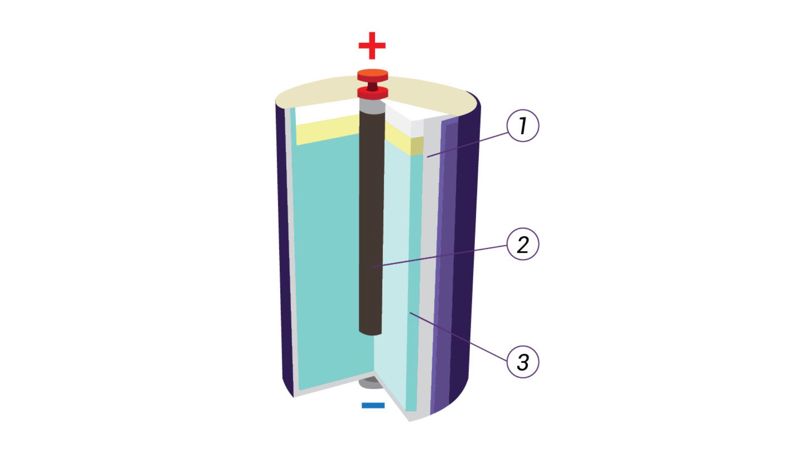
Galvaniniai elementai yra labiausiai pasaulyje paplitę elektros srovės šaltiniai. Tikriausiai teko matyti cilindro formos kišeninio žibintuvėlio elementus (2.2.4 pav., a). Tyrėjo L. Galvanio garbei jie vadinami galvaniniais elementais. Galvaninis elementas yra nuolatinės elektros srovės šaltinis, kuriame cheminė energija virsta elektros srovės energija. Galvaninį elementą sudaro cilindrinis cinko indas (1) ir anglies strypelis (2), įdėtas į maišelį su mangano oksido ir anglies mišiniu (2.2.4 pav., b). Cilindras užpildytas elektrolitu – pastos (arba miltelių) pavidalo chemine medžiaga, pagaminta iš krakmolo (arba miltų) ir amonio chlorido tirpalo mišinio (3).
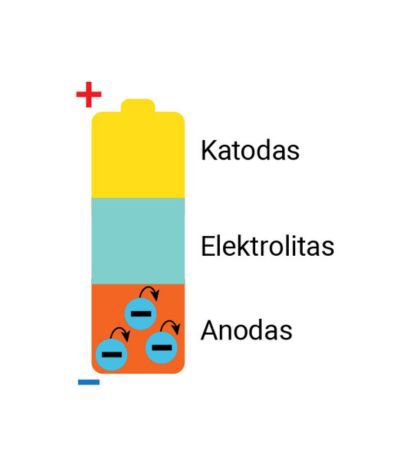
Galvaniniame elemente vyksta cheminės reakcijos. Cinkui sąveikaujant su amonio chloridu susidaro laisvieji elektronai ir teigiamieji jonai (2.2.4 pav., c). Iš cinko atomų susidarę teigiamieji jonai juda elektrolitu ir pasiekę anglies strypelį jį įelektrina teigiamai. Dėl likusių laisvųjų elektronų pertekliaus cinko indas įsielektrina neigiamai.
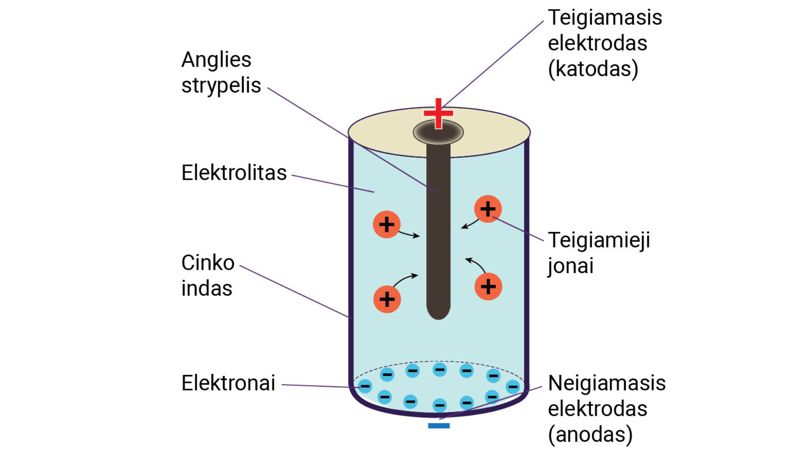
Įelektrintas cinko indas ir anglies strypelis vadinami elektrodais, kitaip – elektros gnybtais. Jie pažymėti pliusu ir minusu (2.2.4 pav.). Išorinis elemento korpusas ir jo apačia sudaro neigiamąjį elektrodą, o anglies strypelis – teigiamąjį elektrodą. Šie elektrodai dar vadinami srovės šaltinio poliais.
Cheminės reakcijos galvaniniame elemente
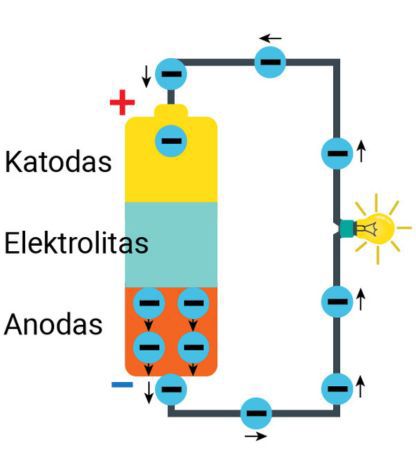
Galvaninio elemento elektrodus sujungus laidininku (2.2.5 pav., a) elektros srovės šaltinyje vyksta dviejų rūšių reakcijos:
- neigiamojo elektrodo paviršiuje atomai virsta teigiamaisiais jonais ir laisvaisiais elektronais;
- teigiamojo elektrodo paviršiuje laisvieji elektronai prisijungia prie teigiamųjų jonų (rekombinuoja).
Gali kilti klausimas, kodėl elektronai nepereina tiesiai iš neigiamojo elektrodo per elektrolitą į teigiamąjį elektrodą. Elektronams pereiti trukdo pats elektrolitas, veikiantis beveik kaip izoliatorius (2.2.5 pav., b). Lengviausias kelias elektronams į teigiamąjį elektrodą yra per išorinę grandinę (2.2.5 pav., a).
Galvaninio elemento elektrodai gaminami tik iš dviejų skirtingos medžiagos laidininkų, taigi, ne iš to paties metalo. Viena medžiaga turi būti linkusi atsisakyti elektronų (mūsų nagrinėtu atveju – cinkas), o kita juos priimti (mūsų atveju – anglies strypelis). Jei abu elektrodai būtų pagaminti iš tos pačios medžiagos, juos sujungus laidininku elektros srovė netekėtų. Galvaniniuose elementuose aktyvioji cheminė medžiaga panaudojama tik kartą. Jai išsieikvojus galvaninis elementas nustoja veikti.
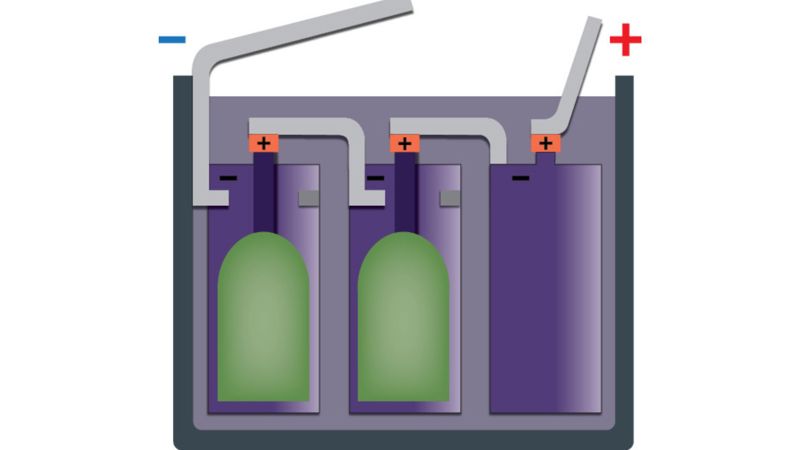
Baterija
Keli tarpusavyje sujungti galvaniniai elementai sudaro bateriją (2.2.6 pav., a). Plokščios formos baterijoje yra trys tarpusavyje sujungti galvaniniai elementai (2.2.6 pav., b). Pirmo galvaninio elemento anglies strypelis (teigiamasis elektrodas) sujungtas su antro galvaninio elemento cinko indu (neigiamuoju elektrodu). Antro elemento anglies strypelis sujungtas su trečio elemento cinko indu.
Bateriją galima palyginti su dėže: didesnėje dėžėje telpa daugiau daiktų, ir baterijos dydis parodo, kiek elektros energijos joje yra. Baterijos žymimos raidėmis: AAA, AA, C, D. Didesnėse baterijose (C, D) yra daugiau cheminio elektrolito ir didesni elektrodai, todėl jos gali veikti ilgiau nei AAA ir AA tipo baterijos.
Akumuliatoriai
Galvaniniai elementai yra pirminiai, arba vienkartiniai, elektros srovės šaltiniai. Elektros akumuliatoriai (lot. accumulare – kaupti) yra antriniai elektros srovės šaltiniai, kaupiantys cheminę energiją. Pirmąjį rūgštinį (švino) akumuliatorių 1859 m. sukūrė prancūzų fizikas Gastonas Plantė (Gaston Planté, 1834–1889). Tokį akumuliatorių sudaro metalinio švino ir švino dioksido plokštės, įmerktos į sieros rūgšties tirpalą. Keturiasdešimčia metų vėliau išrastas šarminis akumuliatorius yra patvaresnis ir lengvesnis už rūgštinį. Tokio akumuliatoriaus plokštės panardintos į šarmo skiedinį.
Kad akumuliatorius taptų elektros srovės šaltiniu, reikia jį įkrauti. Akumuliatorius įkraunamas jį prijungus prie elektros srovės šaltinio: teigiamąjį akumuliatoriaus polių reikia prijungti prie teigiamojo elektros srovės šaltinio poliaus, o neigiamąjį polių – prie neigiamojo elektros srovės šaltinio poliaus (2.2.7 pav.). Įkraunant akumuliatorių vyksta cheminės reakcijos: vienas akumuliatoriaus elektrodas įgauna teigiamąjį, o kitas neigiamąjį krūvį. Kitaip tariant, elektros energija virsta chemine energija. Įkrautas akumuliatorius veikia kaip savarankiškas elektros srovės šaltinis. Tuomet cheminė energija virsta elektros energija.
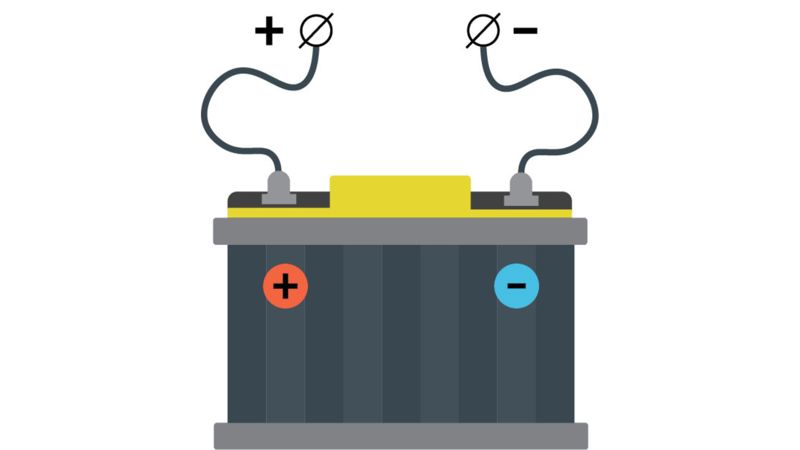
Apskaičiuota, kad šiuo metu naudojamų automobilių akumuliatorių energijos kiekis prilygsta visų pasaulio elektrinių gaminamam energijos kiekiui. Naujausi yra ličio jonų (Li-Ion) akumuliatoriai, kurie naudojami elektromobiliuose, mobiliuosiuose telefonuose, nešiojamuosiuose kompiuteriuose, brangiose vaizdo kamerose. Ličio jonų akumuliatoriai pasižymi optimaliu elektrinės talpos ir masės santykiu, mažiau kenkia aplinkai, tačiau yra brangūs.
Klausimai ir užduotys
- Kokie energijos virsmai vyksta galvaniniame elemente?
- Ar galima pasigaminti galvaninį elementą į citriną įbedus du varinius laidus? Atsakymą pagrįskite.
- Kas vyksta galvaniniame elemente jo gnybtus sujungus su laidininku?
- Kodėl galvaninio elemento viduje elektronai nepereina iš anodo į katodą?
- Pasigaminkite galvaninio elemento modelį iš trijų spalvų plastilino. Apibūdinkite galvaninio elemento sandarą, paaiškinkite, kaip jis veikia.
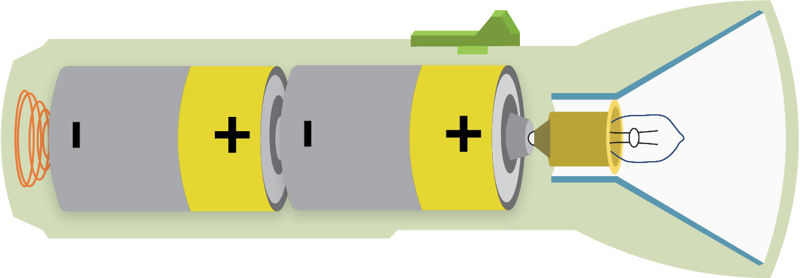
- Kas sudaro bateriją? Ar kišeninio žibintuvėlio elementai (2.2.8 pav.) sudaro bateriją?
- Kokie energijos virsmai vyksta akumuliatorių įkraunant ir jam išsikraunant?
- Kur naudojami akumuliatoriai? Pasidomėkite vaikiškų elektromobilių akumuliatoriais ir jų charakteristikomis. Padiskutuokite, kokie vaikiškų elektromobilių akumuliatoriai yra geriausi.