Atomai ir elementai
Jau žinome, kad visi kūnai sudaryti iš medžiagų. Iš ko sudarytos medžiagos? Šis klausimas nuo seno jaudino žmoniją. Dar prieš daugiau kaip 2000 metų senovės graikų filosofas Platonas (427–347 m. pr. Kr.) pasiūlė elementais pavadinti žemę, ugnį, vandenį ir orą (5.2.1 pav.).

Iš šių elementų, filosofų nuomone, sudarytos visos medžiagos. Viduramžiais buvo manoma, kad iš šių elementų galima pagaminti auksą – tereikia rasti niekam nežinomą filosofinį akmenį, ir jis padės tai padaryti. Beveik visuose didikų rūmuose mokslininkai ieškojo būdų, kaip nevertingus metalus (pavyzdžiui, gyvsidabrį, alavą ir kitus) paversti auksu. Tai buvo alchemijos amžius (5.2.2 pav.). Alchemikai sukūrė ir ištyrė daugybę medžiagų. Netrukus elementais buvo pavadinti ir siera, gyvsidabris, alavas ir daug kitų.
Nors niekam aukso taip ir nepavyko pagaminti, alchemikų atradimai padėjo mokslui. Cheminiais elementais imta vadinti daug naujai atrastų paprastųjų medžiagų, iš kurių sudarytos visos likusios medžiagos. Elementus imta žymėti įvairiais simboliais (5.2.3 pav.). XIX a. švedų mokslininkas Jensas Jakobas Berselijus (5.2.4 pav.) pasiūlė elementus įvardyti raidėmis, išvestomis iš jų lotyniškų ar graikiškų pavadinimų. Toks elementų žymėjimo būdas išliko iki šių dienų (5.2.1 lentelė).

5.2.1 lentelė. Kai kurių elementų pavadinimai ir simboliai
Elemento | Lotyniškas | Simbolis |
Alavas | Stannum | Sn |
Aliuminis | Alumen | Al |
Anglis | Carbo, Carbonium | C |
Auksas | Aurum | Au |
Azotas | Nitrogenium | N |
Deguonis | Oxygenium | O |
Fosforas | Phosphorus | P |
Geležis | Ferrum | Fe |
Gyvsidabris | Hydrargyrum | Hg |
Jodas | Iodum | I |
Siera | Sulfurium | S |
Sidabras | Argentum | Ag |
Tai įdomu! Žymus švedų mokslininkas Jensas Jakobas Berselijus (Jöns Jacob Berzelius) laikomas vienu iš šiuolaikinės chemijos mokslo kūrėjų. Vaikystėje neteko abiejų tėvų, juo rūpinosi giminės. J. J. Berselijus studijavo garsiajame Ùpsalos universitete, jam dėstė labai žymūs to meto mokslininkai. Būdamas 29-erių, tapo Švèdijos mokslų akademijos nariu. Atrado cheminius elementus cerį, seleną, pirmasis pasaulyje išskyrė elementus silicį, torį, cirkonį. Mokslininkas pasiūlė labai daug iki šiol vartojamų mokslo pavadinimų. Už šiuos atradimus gavo gausybę apdovanojimų, jo darbus labai vertino kitų šalių mokslininkai.

Šiuo metu žinoma 118 cheminių elementų. Jie išdėstyti lentelėje, kurios principus 1869 m. pasiūlė rusų mokslininkas Dmitrijus Mendelejevas (5.2.5 pav.).
Chèminiais elemeñtais vadinamos paprastosios medžiagos, iš kurių sudarytos visos kitos medžiagos. Elementai žymimi simboliais.

Tai įdomu! Dmitrijus Mendelejevas (1834–1907) – rusų mokslininkas. Jis buvo jauniausias iš labai religingos gausios 14 vaikų šeimos. Vaikystė prabėgo tolimajame Sibire. Bandė įstoti į Maskvõs universitetą, bet jo nepriėmė. Mokslus baigė 1850 m. Peterbùrgo pedagoginiame institute, stažavosi Heidelberge (Vokietijà). Išspausdino vadovėlį, o jame pirmą kartą išdėstė cheminių elementų grupavimo principus. D. Mendelejevas pasakojo, kad susapnavo šią lentelę ir pabudęs greitai pavaizdavo. Savo garsųjį atradimą mokslininkas paskelbė 1869 metais. Šis pasiekimas buvo visuotinai pripažintas ir įvertintas įvairiomis premijomis bei medaliais.
Elementų savybės labai skiriasi. Vieni yra dujos, kiti – kietosios medžiagos, tik du yra skysčiai. 94 elementai gali būti randami Žemėje. Likusius mokslininkai sukūrė laboratorijose. Kai kurie yra labai nepastovūs ir suskyla per trumpą laiką. Panašūs reiškiniai vyksta ir Saulėje. Elementams jungiantis ir skylant, milijonus metų šviesą spinduliuoja Saulė ir žvaigždės. Jei mokslininkai išmoktų suvaldyti šiuos kismus, žmonija turėtų neišsenkamą energijos šaltinį.
Cheminius elementus sudaro mažytės dalelės – atòmai. Atomas yra mažiausia cheminio elemento dalelė.
Anglų mokslininkas Dž. Daltonas buvo pirmasis, kuris 1800 m. įrodė, kad elementai jungiasi tarpusavyje tam tikru santykiu. Jų masės vienetai, pavyzdžiui, išreikšti gramais, visados yra tokie patys. Buvo nustatyta, kad, susidarant vandeniui, visados jungsis 2 g vandenilio su 16 g deguonies. Taigi, buvo aišku, kad elementus sudaro mažos nematomos dalelės.
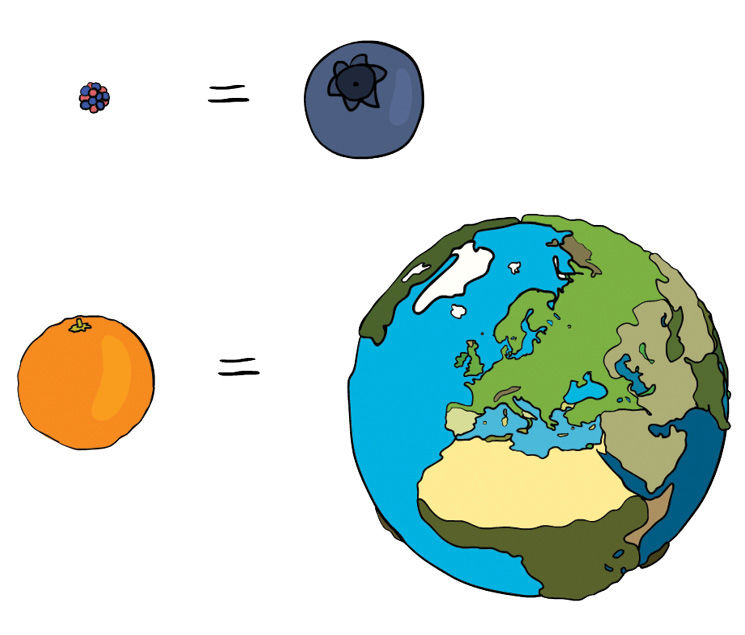
Atomai – tokie maži, kad jų negalima pamatyti net pro stipriausius mikroskopus. Apskaičiuota, kad, sudėjus milijoną anglies atomų vieną prie kito, gautume žmogaus plauko storio liniją. Jei įsivaizduotume, kad atomas yra mėlynės dydžio kamuoliukas, tai, sudėję tiek atomų, kiek jų yra viename apelsine, gautume Žemės dydžio kamuolį (5.2.6 pav.)!
Dauguma atomų jungiasi su kitais atomais į didesnes daleles, vadinamas molèkulėmis. Kaip jau žinote, molèkulės yra mažiausios medžiagų dalelės, pasižyminčios tos medžiagos savybėmis.
Molekules gali sudaryti ir to paties, ir skirtingų elementų atomai. To paties cheminio elemento atomai jungiasi palyginti silpnais ryšiais, o skirtingų elementų atomai – dažniausiai labai stipriais ryšiais, kuriuos išardyti kartais būna labai sunku.
Kelių molekulių pavyzdžius jau žinote, pavyzdžiui, vandens. Jis susidaro susijungus vandeniliui su deguonimi. Kita medžiaga – anglies dioksidas, jis gaunamas angliai susijungus su deguonimi. Elementai vieni su kitais jungiasi ne bet kaip, o pagal tam tikrus dėsnius. Be to, elementai susijungia tik tam tikru santykiu. Pavyzdžiui, anglies dioksido molekulė susidaro, kai vienas anglies atomas susijungia su dviem deguonies atomais. Kad būtų paprasčiau, šis atomų susijungimo būdas parašomas formulėmis. Jose pažymimas elemento simbolis ir to elemento atomų skaičius vienoje molekulėje. Taigi, žinodami, kad anglies dioksido molekulė sudaryta iš vieno anglies atomo ir dviejų deguonies atomų, šios molekulės formulę užrašome taip: CO₂, čia C – anglies simbolis, O – deguonies simbolis, o skaičius 2 (indeksas) nurodo deguonies atomų skaičių.
Tai įdomu! J. J. Berselijus, kuris pasiūlė elementų žymėjimo būdą, molekules užrašyti siūlė kiek kitaip – atomų skaičių nurodyti elemento simbolio viršuje. Taigi, anglies dioksido formulė, pasak J. J. Berselijaus, galėtų būti užrašyta taip: CO². Tačiau toks būdas neprigijo.
Klausimai ir užduotys
- Kas yra cheminis elementas? Kaip priimta žymėti cheminius elementus?
- Ką vadiname atomais? Kas yra molekulės? Kaip žymimas atomų skaičius molekulėje?
- Kieno savybėmis pasižymi molekulės? Ar skiriasi molekulių ir jas sudarančių atomų savybės?
- Užrašykite molekulės, sudarytos iš dviejų vandenilio atomų ir vieno deguonies atomo, formulę (elementų simbolius žr. 5.2.1 lentelėje). Kaip vadinama ši medžiaga?
- Vykstant augalų fotosintezei, iš anglies dioksido ir vandens molekulių, naudojant šviesos energiją, susidaro gliukozės ir deguonies molekulės. Gliukozės molekulę sudaro šeši anglies, dvylika vandenilio ir šeši deguonies atomai. Užrašykite jos formulę panaudodami elementų simbolius.
Ko išmokome?
- Šiuo metu žinoma 118 cheminių elementų, iš kurių sudarytos visos medžiagos. 94 iš šių elementų randami gamtoje.
- Mažiausia elemento dalelė yra atomas. Atomai yra be galo mažos dalelės.
- Mažiausia medžiagos dalelė, turinti tos medžiagos savybių, yra molekulė.
- Molekulių sudėtis gali būti užrašyta formulėmis, kuriomis žymimi elementų atomų simboliai ir tų atomų skaičius.
