Šiame skyriuje mokysitės apie elektros srovę įvairiose terpėse: skysčiuose, dujose, puslaidininkiuose. Susipažinsite su elektros srovės skirtingose terpėse pavyzdžiais ir taikymu. Mokysitės apie puslaidininkinius prietaisus – diodus, fotoelementus.
Elektros srovė skysčiuose
Naujos sąvokos:
elektrodas, anodas, katodas, elektrolitinė disociacija, elektrolitas, elektrolizė
Jau žinote, kaip elektros srovė atsiranda metaluose. Ją sukelia kryptingas laisvųjų elektronų, veikiamų elektrinio lauko, judėjimas. Tačiau elektros srovė gali tekėti ne tik metaliniais laidininkais. Dabar aptarsime, kaip elektros srovė atsiranda skysčiuose ir kur šis reiškinys pritaikomas praktiškai.
Šios temos naujų sąvokų sąraše pateiktoms sąvokoms beveik 200 metų. Jas XIX a. pirmoje pusėje pirmą kartą pavartojo ne sykį šiame vadovėlyje minėtas anglų mokslininkas M. Faradėjus.
Elektrolitai
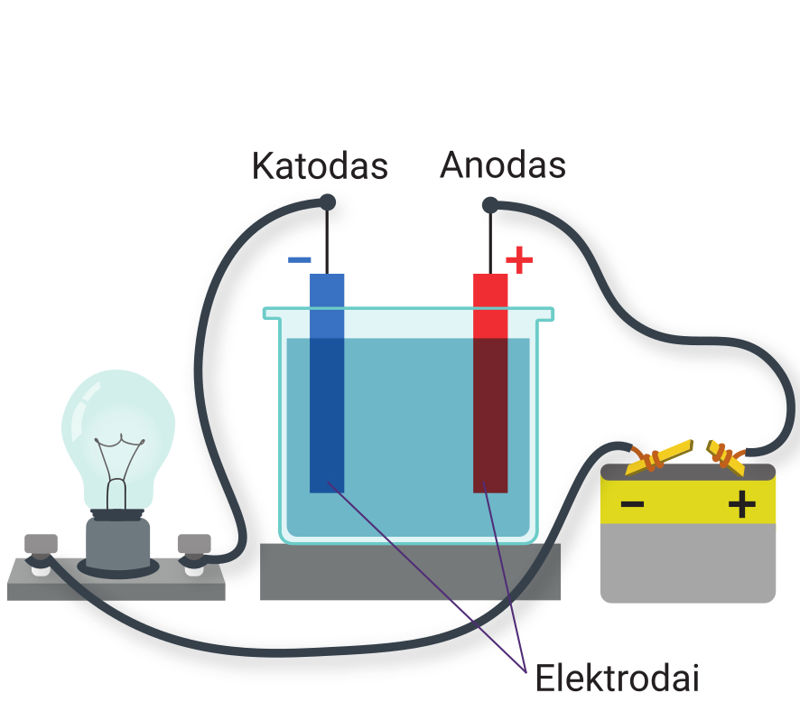
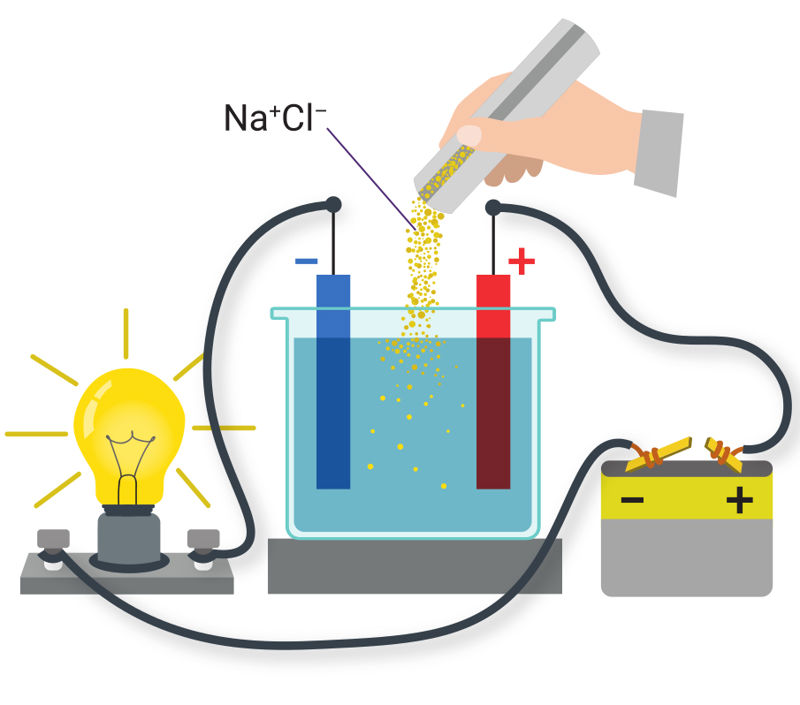
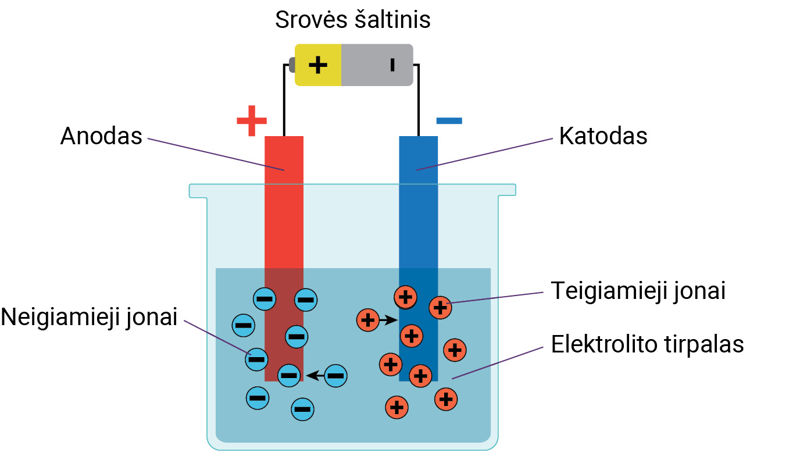
Skysčiai gali būti laidininkai, puslaidininkiai arba dielektrikai. Tuo galima įsitikinti atliekant bandymus. Sujungiama elektros grandinė, kurią sudaro srovės šaltinis, jungiamieji laidai, indas su distiliuotu vandeniu ir dvi metalinės plokštelės (5.1.1 pav., a). Metalinės plokštelės, sujungtos su elektros srovės šaltiniu, vadinamos elektrodais (elektro… + gr. hodos – kelias) (5.1.1 pav., a). Elektrodas, sujungtas su neigiamuoju šaltinio poliumi, vadinamas katodu (gr. kathodos – kelias žemyn, nusileidimas), o sujungtas su teigiamuoju šaltinio poliumi – anodu (gr. anodos – kelias aukštyn) (5.1.1 pav., a). Kai elektrodai panardinti į distiliuotą vandenį, elektros srovė grandinėje neteka, elektros lemputė nešviečia (5.1.1 pav., a). Į vandenį įbėrus valgomosios druskos elektros grandine ima tekėti srovė – elektros lemputė įsižiebia (5.1.1 pav., b). Medžiagos, kurių vandeniniais tirpalais arba lydalais gali tekėti elektros srovė, vadinamos elektrolitais. Elektrolitai gaunami vandenyje ištirpinus cheminius junginius (druskas, rūgštis, šarmus).
Elektrolitinė disociacija
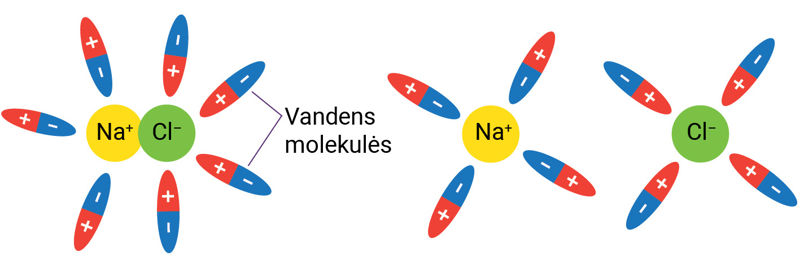
Tirpinami cheminiai junginiai suskyla į jonus (5.1.2 pav.). Vandens molekulės dėl elektrostatinės sąveikos (priešingų ženklų elektros krūviai vienas kitą traukia) apsupa valgomosios druskos molekulę ir ją suardo. Tirpinamų junginių skaidymas į jonus vadinamas elektrolitine disociacija (lot. dissociatio – atskyrimas, suskaidymas). Taip vandeniniame tirpale atsiranda elektringųjų dalelių – teigiamųjų ir neigiamųjų jonų.
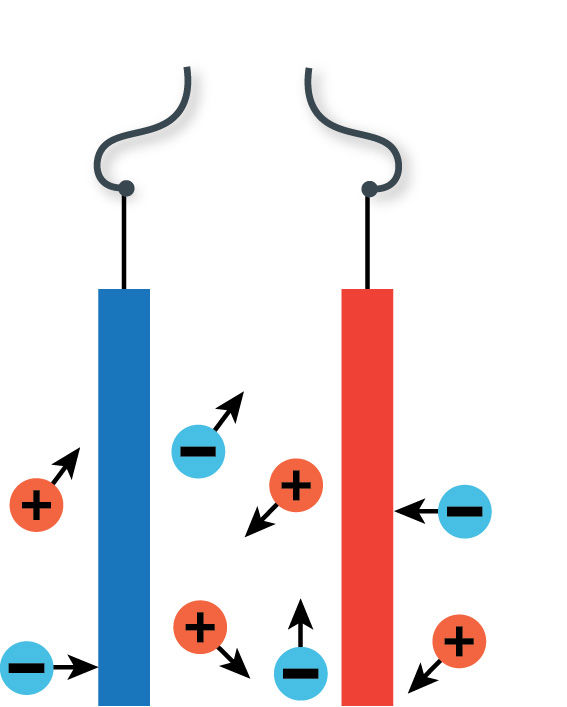
Dėl elektrolitinės disociacijos susidarę jonai juda netvarkingai (5.1.3 pav., a). Prie elektrodų prijungus elektros srovės šaltinį atsiranda elektrinis laukas. Jo veikiami teigiamieji jonai juda neigiamojo elektrodo link, o neigiamieji jonai – teigiamojo elektrodo link (5.1.3 pav., b). Šis jonų judėjimas ir yra elektros srovė. Taigi, elektros srovė elektrolitų tirpaluose yra kryptingas teigiamųjų ir neigiamųjų jonų judėjimas. Todėl elektrolitų tirpalų laidumas vadinamas joniniu.
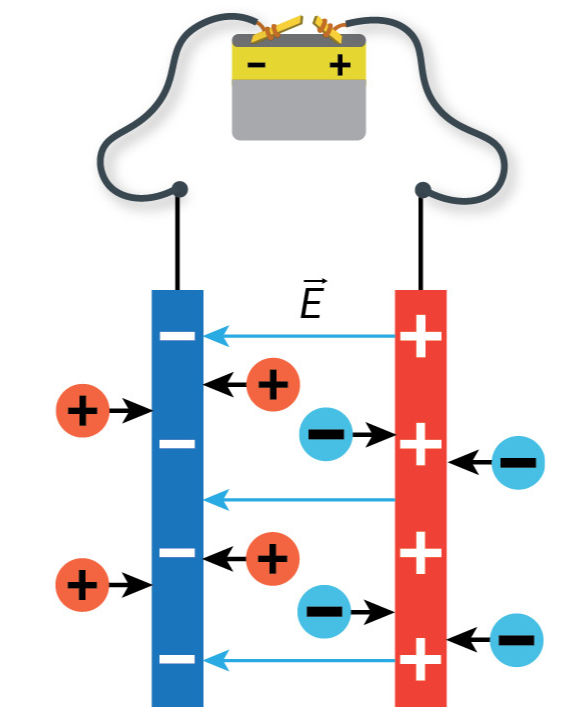
Elektrolizė
Elektros srovei tekant elektrolito tirpalu ant elektrodų atsiranda nuosėdų. Jos išsiskiria teigiamiesiems ir neigiamiesiems jonams nusėdant ant elektrodų (5.1.4 pav.). Teigiamieji jonai, pasiekę katodą, prisijungia trūkstamus elektronus ir virsta neutraliaisiais atomais. Neigiamieji jonai, pasiekę anodą, atiduoda perteklinius elektronus ir virsta neutraliaisiais atomais. Medžiagos išsiskyrimas ant elektrodų elektrolitu tekant elektros srovei vadinamas elektrolize.
1833 m. anglų mokslininkas M. Faradėjus nustatė ryšį tarp pratekėjusios elektros srovės ir ant elektrodų nusėdusios medžiagos kiekio. Paaiškėjo, kad nusėdusios medžiagos masė priklauso ir nuo elektrolito medžiagos. Fizikinis dydis, apibūdinantis nusėdusios medžiagos masės priklausomybę nuo elektrolito medžiagos, vadinamas elektrocheminiu medžiagos ekvivalentu ir žymimas raide k. Taigi, ant elektrodo nusėdusios medžiagos masė priklauso nuo elektrolito medžiagos (k), elektros srovės stiprio (I) ir elektros srovės tekėjimo trukmės (t):
m = kIt. (5.1)
Elektrocheminio medžiagos ekvivalento matavimo vienetas reiškiamas kilogramais kulonui:
[k] = 1 kg/C.
Elektros srovės cheminio veikimo taikymas
Elektrolizė – elektros srovės cheminio veikimo apraiška. Ji padeda iš druskų ir oksidų išskirti grynuosius metalus: varį, nikelį, aliuminį.
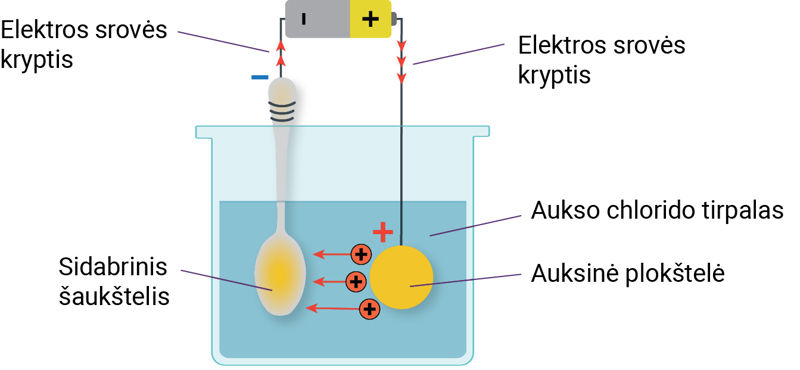
Elektrolizė vyksta metalo gaminius dengiant plonu kitų metalų sluoksniu – auksuojant, sidabruojant, nikeliuojant. Elektrolitinis gaminių dengimas plonu metalo sluoksniu vadinamas galvanostegija (sudurtinio žodžio dalis galvano reiškia sąsają su elektros srove, gr. stegō – dengiu). Taikant galvanostegiją puošiami ir nuo oksidacijos apsaugomi įvairūs gaminiai. Aptarkime, kaip tai daroma. Pavyzdžiui, norima paauksuoti sidabrinį šaukštelį. Sidabrinis šaukštelis prijungiamas prie neigiamojo srovės šaltinio poliaus (5.1.5 pav.). Prie teigiamojo srovės šaltinio poliaus prijungiama auksinė plokštelė. Šaukštelis ir plokštelė panardinami į aukso chlorido tirpalą (tampa elektrodais). Auksinė plokštelė reaguoja su aukso chlorido tirpalu, susidaro teigiamieji aukso jonai. Veikiami elektrinio lauko, jie juda prie neigiamojo elektrodo (sidabrinio šaukštelio) – elektrolitu teka elektros srovė (5.1.5 pav.). Pasiekę sidabrinį šaukštelį teigiamieji aukso jonai prisijungia elektronus, virsta neutraliaisiais aukso atomais ir nusėda ant šaukštelio paviršiaus. Pamažu sidabrinis šaukštelis apsitraukia auksu.
Taikant elektrolizę ant gaminio paviršiaus iš pradžių nusodinamas, o paskui atskiriamas storas metalo sluoksnis. Gaminių tikslių kopijų gavimas elektrolizės būdu vadinamas galvanoplãstika. Taip kuriamos meno kūrinių kopijos, skulptūros (5.1.6 pav.).
Medicinoje elektrolizė taikoma žmogaus organizmui valyti ir energijos pusiausvyrai atkurti (5.1.7 pav.).
Klausimai ir užduotys
- Ką vadiname elektrolitine disociacija? Kokių elektringųjų dalelių atsiranda jai vykstant?
- Ką vadiname elektrolitais? Pateikite elektrolitų pavyzdžių.
- Kas yra elektrolizė? Kas susidaro vykstant elektrolizei?
- Pateikite elektrolizės taikymo pavyzdžių.
- Elektros srovei tekant vario sulfato tirpalu ant neigiamojo elektrodo nusėda vario. Kaip pasikeis ant elektrodo nusėdusio vario masė, jei srovės stiprį padidinsime 6 kartus, o jos tekėjimo trukmę sutrumpinsime 3 kartus?
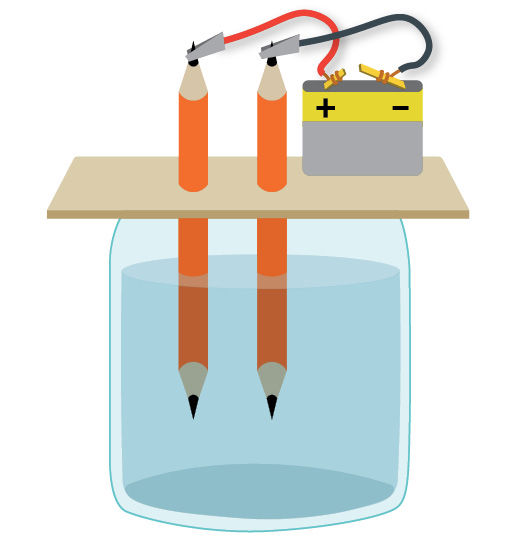
- Taikydami elektrolizę pasigaminkite namuose daugiau deguonies. Bandymui atlikti reikės dviejų pieštukų, elektros srovės šaltinio ir indo su vandeniu, kuriame ištirpinta šiek tiek valgomosios druskos (5.1.8 pav.). Vykstant elektrolizei vanduo skaidomas, išsiskiria vandenilio ir deguonies dujos. Ant kurio pieštuko išsiskiria deguonis, o ant kurio vandenilis? Internete paieškokite informacijos apie šį bandymą.
Pažiūrėkite filmuką, kaip vyksta elektrolizė.
- Elektros srovė tekėjo vario sulfato tirpalu. Vykstant elektrolizei iš jo per 0,5 h išsiskyrė 10 g vario. Kokio stiprio elektros srovė tekėjo elektrolitu? Vario elektrocheminis ekvivalentas yra 0,33 ⋅ 10–6 kg/C. (16,8 A)
- Vykstant elektrolizei vario sulfato tirpalu pratekėjo 60 C elektros krūvis. Kokia ant elektrodo nusėdusio vario masė? (19,8 ⋅ 10–6 kg)


