Mažiáusios enèrgijos principas, Páulio draudimo principas, Hùndo taisỹklė, elektrònų pasiskirstymas slúoksniuose ir orbitãlėse.
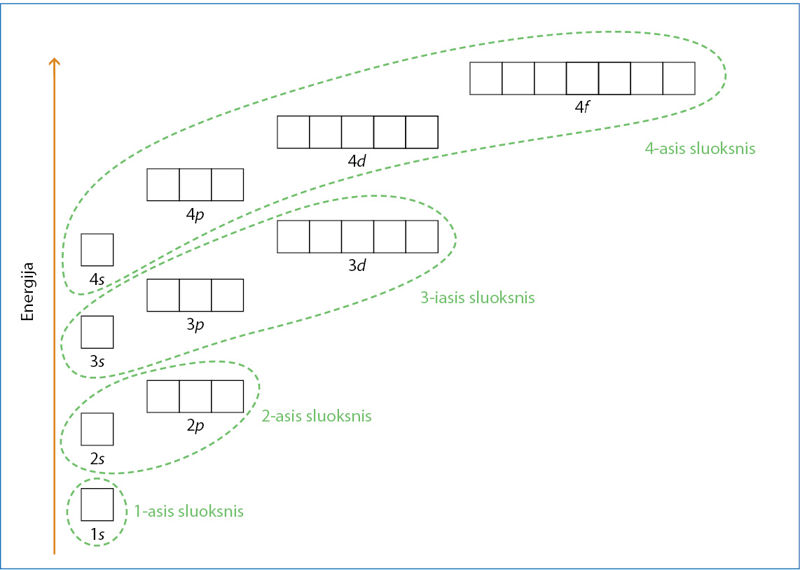
Orbitalių energinė diagrama
Būtų sudėtinga kaskart piešti orbitalių formas. Kad būtų paprasčiau, bet kokio tipo orbitales vaizduojame kvadratu (žr. 2.5 temos 2.5.2 pav., b).
Pirmajame sluoksnyje yra n2 = 12 = 1 orbitalė, tad braižome vieną kvadratą (2.6.1 pav.). Ši orbitalė yra s tipo ir žymima 1s (skaičius 1 rodo sluoksnio numerį, o s – orbitalės tipą). Antrajame sluoksnyje yra n2 = 22 = 4 orbitalės. Pirmoji jų yra 2s orbitalė, o likusios trys – 2p orbitalės. Visos antrojo sluoksnio orbitalės yra gerokai didesnės energijos už pirmojo sluoksnio. Antrojo sluoksnio 2p orbitalių energija šiek tiek didesnė už 2s orbitalės. Todėl 2.6.1 paveiksle vienos orbitalės pavaizduotos žemiau, kitos aukščiau. Analogiškai trečiajame sluoksnyje yra n2 = 32 = 9 orbitalės: viena s, trys p, o likusios yra d orbitalės. Taigi kiekvienas tolesnis sluoksnis atkartoja žemiau esantį sluoksnį ir yra papildomas vieno naujo tipo orbitalėmis. Naujų orbitalių yra tiek, kiek trūksta iki n2 reikšmės.
Paulio draudimo principas
Orbitalė gali būti tuščia, turinti vieną elektroną arba elektronų porą (2.6.2 pav.). Volfgangas Ernstas Paulis (Wolfgang Ernst Pauli, 1900–1958) suformulavo vadinamąjį Páulio draudimo principą:
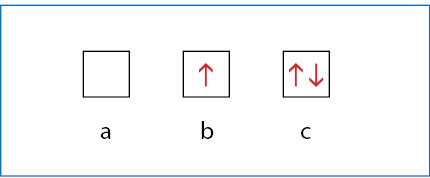
Vienoje orbitalėje gali būti ne daugiau kaip du elektronai (elektronų pora), ir jie turi būti priešingų sukinių.
Mažiausios energijos principas ir Hundo taisyklė
Norint išsiaiškinti elektronų pasiskirstymą orbitalėse, pirmiausia nusibraižoma orbitalių diagrama (2.6.1 pav.) iš tiek sluoksnių, koks yra elemento periodo numeris. Elektronai į orbitales paskirstomi vadovaujantis trimis taisyklėmis:
- mažiausiosios energijos principu;
- Hundo taisykle;
- Paulio draudimo principu.
Mažiáusios enèrgijos principas: kol yra laisvų mažesnės energijos orbitalių, elektronai neužima didesnės energijos orbitalių.
Tad pirmieji du elektronai užima mažiausios energijos 1s orbitalę. Tik tada užimamos 2s, 2p ir kitos orbitalės. Orbitalių pildymo elektronais seka:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p.
Atkreipkite dėmesį į raudonai pažymėtas orbitales – pirma užpildomos 4s orbitalės, tik tada tęsiamas trečiojo sluoksnio pildymas (3d orbitalėmis). Trečiajame sluoksnyje telpa 18 elektronų, bet kol jis yra išorinis, jame būna ne daugiau nei aštuoni elektronai. Atsiradus naujam – ketvirtajam – sluoksniui, dėl didesnio branduolio krūvio ir orbitalių energijos pokyčių vėl pradeda gausėti elektronų trečiajame sluoksnyje.s
Kitą orbitalių pildymo elektronais taisyklę suformulavo vokiečių fizikas Frydrichas Hermanas Hundas (Friedrich Hermann Hund, 1896–1997).
Hùndo taisỹklė: vienodos energijos orbitalėse (pvz., trijose 2p orbitalėse) elektronai pirmiausia pasiskirsto po vieną kiekvienoje orbitalių. Be to, visų pavienių elektronų sukiniai turi būti vienodi.
Pavyzdžiui, trys elektronai p orbitalėse pasiskirsto taip:
|  | |
Hundo taisyklė galioja dėl elektronų tarpusavio stūmos – naudingiau, kad vienas kitą stumiantys elektronai būtų skirtingose erdvės dalyse, t. y. orbitalėse. Taip pasiskirsčius atomo energija yra mažesnė.
Tik tada, kai vienodos energijos orbitalės užpildomos pavieniais elektronais, prasideda elektronų porų susidarymas. Elektronų poros susidaro laikantis pirmiau aptarto Paulio draudimo principo, t. y. iš priešingų sukinių elektronų. Keturi elektronai p orbitales užima taip:
|  | |
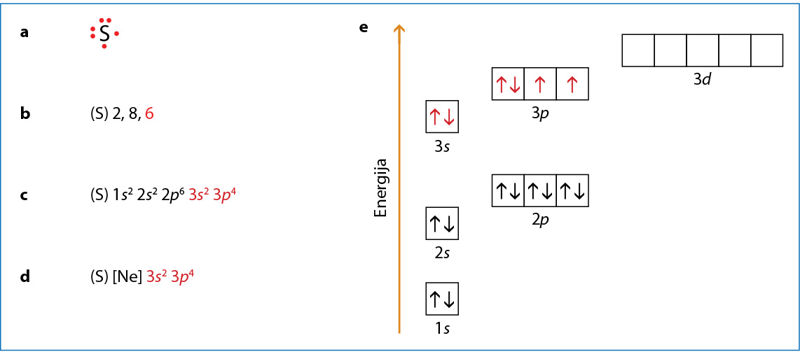
Sieros elektroninė sandara
Kaip pavyzdį išnagrinėkime sieros atomo elektronų konfigūraciją ir jos užrašymo būdus. Sieros atomas turi 16 elektronų, jie išsidėstę trimis sluoksniais. Šių elektronų pasiskirstymą sluoksniuose ir orbitalėse galima parodyti įvairiomis elektroninėmis formulėmis, kurios užrašytos ir paaiškintos 2.6.3 paveiksle.
Klausimai ir užduotys
- Orbitalių ir didžiausią elektronų skaičių sluoksnyje galima apskaičiuoti naudojantis paprastomis matematinėmis formulėmis. Kiek orbitalių yra trečiajame sluoksnyje? Kiek daugiausia šiame sluoksnyje gali būti elektronų?
- Kiek valentinių elektronų turi:
- fluoras;
- boras;
- natris?
- Keliais sluoksniais išsidėstę elektronai šiuose atomuose:
- anglies;
- rubidžio;
- ksenono?
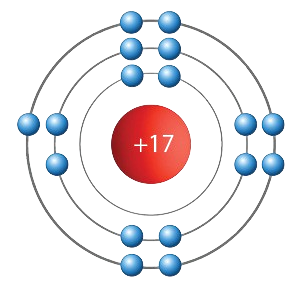
- Atomo elektroninė sandara supaprastintai parodyta tokiu piešiniu.
- Kurio elemento atomo sandara čia parodyta?
Parašykite šio elemento: - Luiso formulę;
- elektronų pasiskirstymą orbitalėse atspindinčią elektroninę formulę
- Kurio elemento atomo sandara čia parodyta?