Pirmosios grupės elementų atomų sandara
Jau išsiaiškinome, kad, einant cheminių elementų lentelės periodais iš kairės į dešinę, atomų išoriniame elektronų sluoksnyje didėja elektronų skaičius. Kiekvieno periodo numeris atitinka elektronų sluoksnių skaičių.
O kas būdinga cheminiams elementams, esantiems vienoje grupėje? Kaip kinta jų atomų elektronų skaičius? Grupės yra vertikalieji periodinės elementų lentelės stulpeliai.
Tos pačios grupės elementų atomams būdingos panašios savybės, viena jų – vienodas elektronų skaičius išoriniame sluoksnyje.
Palyginkime pirmosios grupės (IA) elementų – vandenilio, ličio, natrio ir kalio – atomų elektronų išsidėstymą (2.5.1 lentelė).
2.5.1 lentelė. Pirmosios (IA) cheminių elementų grupės elementų atomų sandara
Elementas | Simbolis | Atominis skaičius | Elektronų skaičius | Elektronų skaičius išoriniame sluoksnyje | Elektronų išsidėstymas sluoksniais |
Vandenilis | H | 1 | 1 | 1 | 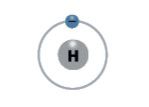 |
Litis | Li | 3 | 3 | 1 | 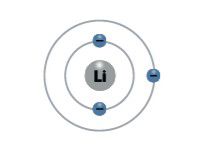 |
Natris | Na | 11 | 11 | 1 | 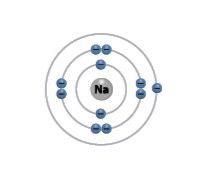 |
Kalis | K | 19 | 19 | 1 | 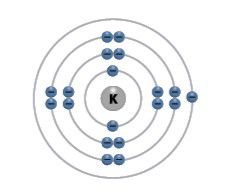 |
Taigi visi šios grupės elementų atomai savo išoriniame elektronų sluoksnyje turi po vieną elektroną, bet skirtingą elektronų sluoksnių skaičių. Augant atomo elektronų sluoksnių skaičiui, didėja ir to atomo spindulys (2.5.1 pav.).

Atòmo spindulỹs yra atstumas nuo atomo branduolio iki tolimiausio elektronų sluoksnio. Atomo spindulys grupėse didėja iš viršaus į apačią.
Kuo labiau elektronai yra nutolę nuo branduolio, tuo silpniau jie yra traukiami ir labai lengvai gali atskilti. Palyginti su vandeniliu, ličiu ir natriu, kalis turi daugiausia elektronų sluoksnių – keturis, todėl lengviausiai atiduos išoriniame sluoksnyje esantį 1 elektroną.
Atomų virtimas jonais
Kai atomas atiduoda arba prisijungia elektronus, jis įgyja krūvį ir tampa jonù – krūvį turinčia dalele. Atiduodamas elektronus atomas virsta teigiamuoju jonu, o prisijungdamas – neigiamuoju.
Iš kalio atomo susidariusi dalelė – jonas – turės 19 protonų ir 18 elektronų. Kadangi kalio atomas prarado elektroną, kalio jono krūvis bus teigiamas – 1+ (2.5.2 pav.).
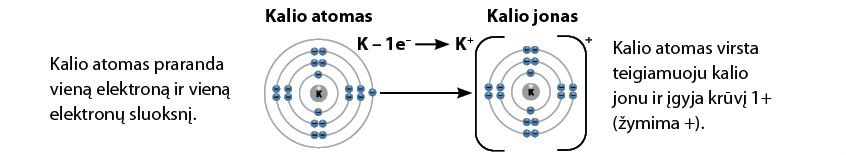
Kalio jono elektronai išsidėstę taip pat kaip argono atomo elektronai – tiek kalio jono, tiek argono atomo išorinis sluoksnis užpildytas. Jau žinote, kad atomai, turintys užpildytą išorinį elektronų sluoksnį, yra stabilesni. Taigi kalio jonas yra gana stabilus.
Gebėjimas lengvai atiduoti išorinio sluoksnio elektroną yra pirmosios grupės elementų atomų savybė. Atidavę elektroną jie virsta teigiamaisiais jonais. Dėl didesnio atomo spindulio kalis savo elektroną atiduoda daug lengviau nei vandenilis.
Litis, natris ir kalis yra minkšti, labai aktyvūs metalai (2.5.3 pav.). Juos galima pjaustyti peiliu. Esant sąveikai su deguonimi, šiuos metalus iškart padengia baltos apnašos, todėl jie laikomi be oro netirpiame vandenyje skystyje, pavyzdžiui, alyvoje, žibale ir pan.

Dar aktyviau šie metalai sąveikauja su vandeniu – užsidega arba sprogsta. Dėl šios priežasties tokie eksperimentai mokykloje neatliekami. Sąveikaujant su vandeniu susidaręs tirpalas tampa šarminis (bazinis), todėl šie metalai vadinami šarminiais metãlais. Šarminiams metalams priskiriami visi IA grupės metalai: litis, natris, kalis, rubidis, cezis ir francis.
Septintosios ir aštuntosios grupės elementų atomų sandara
Dabar apžvelkime aštuntosios (VIIIA) cheminių elementų grupės elementus. Šią grupę sudaro inèrtinės dùjos. Panagrinėkime tris pirmuosius elementus: helį, neoną ir argoną. Kaip matyti iš 2.5.4 paveikslo, šių elementų išorinis elektronų sluoksnis yra užpildytas, jame negali būti daugiau elektronų.
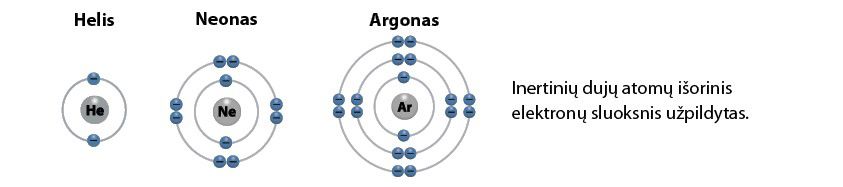
Tai reiškia, kad inertinės dujos nesudaro jokių junginių: jų atomai elektronų nei atiduoda, nei prisijungia. Tai dujos, kurių molekulės sudarytos tik iš vieno atomo. Vienas šių stabilių elementų – argonas – sudaro net 1 % oro sudėties.
Inertinių dujų atomai turi užpildytą išorinį elektronų sluoksnį, todėl šios dujos yra neaktyvios.
Pereikime prie septintosios (VIIA) cheminių elementų grupės. Šios grupės elementai vadinami halogènais. Pagrindiniai šios grupės elementai yra fluoras, chloras, bromas ir jodas. Fluoras ir chloras yra spalvotos dujos, bromas yra skystis, o jodas – kieta kristalinė medžiaga (2.5.2 lentelė). Šios medžiagos labai garuoja ir skleidžia aitrų kvapą. Visi keturi šios grupės elementai yra nemetalai (žr. 2.1 temą).
Halogenai yra labai aktyvūs elementai, nes jų atomams iki išorinio elektronų sluoksnio užpildymo trūksta tik vieno elektrono. Jie prisijungia kitų elementų elektronus ir virsta neigiamąjį krūvį turinčiais jonais. Pavyzdžiui, chloras, prisijungęs elektroną, turi 17 protonų ir 518 elektronų. Todėl jo bendras krūvis yra neigiamas (2.5.5 pav.).
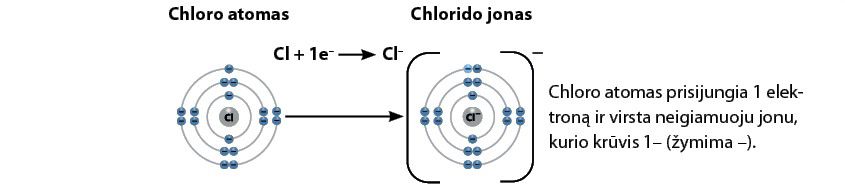
Atkreipkite dėmesį į elektronų skaičių išoriniame elektronų sluoksnyje. Dabar, susidarius neigiamajam jonui, jų yra 8. Vadinasi, elektronų yra lygiai tiek pat, kiek jų turi inertinės dujos. Tokį elektronų skaičių išoriniame sluoksnyje, kaip neigiamojo jono, gauto iš chloro atomo, turi argonas.
Taigi šarminiai metalai linkę atiduoti elektronus, o halogenai juos prisijungia. Natrio (šarminio metalo) ir chloro (halogeno) sąveika (2.5.6 pav.) vyksta labai audringai. Susidaro labai stabili medžiaga – natrio chloridas, arba valgomoji druska. Beje, neigiamojo jono pavadinimas pasikeičia – šiuo atveju jis vadinamas chloridu, bet apie tai sužinosite temos „Cheminių junginių vaizdavimo būdai“ skirsnyje „Cheminių junginių pavadinimai“.
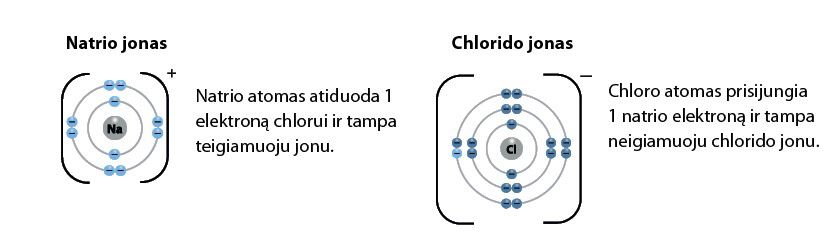
Lygiai taip pat kaip natris su halogenais sąveikauja ir du kiti šarminiai metalai – litis ir kalis: šarminių metalų atomai elektronus atiduoda, o halogenai prisijungia.
Halogenai, kuriems iki išorinio elektronų sluoksnio užpildymo trūksta 1 elektrono, yra labai aktyvūs ir linkę prisijungti elektroną. Prisijungę elektroną, jie virsta neigiamaisiais jonais.
Halogenų savybės skirtingos. Pats aktyviausias yra fluoras, o mažiausiai aktyvus – jodas.
2.5.2 lentelė. Septintosios (VIIA) cheminių elementų grupės elementų atomų sandara
Elementas | Simbolis | Atomo eilės numeris | Forma | Elektronų skaičius išoriniame sluoksnyje | Elektronų išsidėstymas sluoksniais |
Fluoras | F | 9 | 7 | 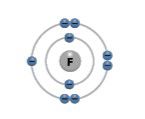 | |
Chloras | Cl | 17 | 7 | 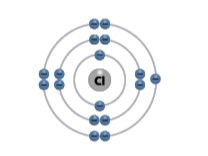 | |
Bromas | Br | 35 |  | 7 | 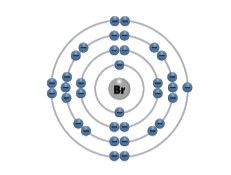 |
Jodas | I | 53 |  | 7 | 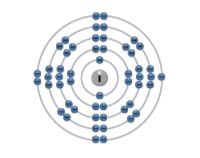 |
Klausimai ir užduotys
- Kuo ypatingi periodinės elementų lentelės IA grupės metalai? Kokios savybės jiems būdingos? Su kuo susijusios tokios šių metalų savybės?
- Kuriai periodinės elementų lentelės grupei priklauso elementas, kurio išoriniame elektronų sluoksnyje yra vienas elektronas?
- Grupei, kurios viršuje yra helis
- Grupei, kurios viršuje yra vandenilis
- Grupei, kurios viršuje yra fluoras
- Grupei, kurios viršuje yra boras
- Pavaizduokite VIIA grupės elementų atomus eilute, jų atomų spindulių didėjimo tvarka.
- atomas prisijungė vieną elektroną. Kiek protonų, neutronų ir elektronų turės iš šio atomo susidaręs jonas?
- Ličio atomas atiduoda elektroną ir tampa jonu. Nupieškite gauto ličio jono elektronų išsidėstymą sluoksniais. Koks šio jono krūvis?
Ko išmokome?
- Tos pačios grupės elementai turi panašių savybių. Tokią ypatybę lemia jų atomų išorinio elektronų sluoksnio sandara.
- Gebėjimas lengvai atiduoti išorinio sluoksnio elektroną yra būdingas pirmosios grupės elementams. Atidavę elektroną, jie virsta teigiamaisiais jonais.
- Halogenai, kuriems iki išorinio elektronų sluoksnio užpildymo trūksta 1 elektrono, yra labai aktyvūs ir linkę prisijungti elektroną. Prisijungę elektroną, jie virsta neigiamaisiais jonais.
- Inertinės dujos, kurios turi užpildytą išorinį elektronų sluoksnį, yra neaktyvios.
- Atomo spindulys yra atstumas nuo atomo branduolio iki tolimiausio elektronų sluoksnio.
- Atomo spindulys grupėse didėja iš viršaus į apačią. Didėjant atomo spinduliui, elektronai prie branduolio traukiami silpniau.
