Santykinė molekulinė masė
Žinome, kad elementų atomai yra nepaprastai mažos dalelės. Jos labai lengvos. Pavyzdžiui, vandenilio atomo tikroji masė lygi m(H) = 1,673 · 10–27 kg, deguonies – 2,657 · 10–26 kg. Norėdami rasti vandens molekulės H2O masę, turime sudėti dviejų vandenilio atomų ir vieno deguonies atomo masę. Taigi vandens molekulės masė lygi:
m(H) + m(H) + m(O) = 2 · 1,673 · 10–27 + 26,57 · 10–27 = 29,916 · 10–27 kg = 2,9916 · 10–26 kg.
Tai labai nepatogu. Todėl chemikai skaičiuoja naudodamiesi atominiu masės vienetu (a. m. v.). 2.3 temoje aptarėme, kad atominiu masės vienetu vadinamas dydis, lygus
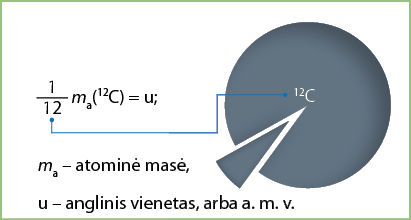
Tai įdomu!
Pirmasis pasiūlęs naudoti santykinę atominę masę buvo Dž. Daltonas. Jis siūlė elementų masę lyginti su vandenilio mase. Vėliau pasirinkta
Santykinė atominė masė daug patogesnė skaičiuoti nei tikroji atomų masė. Ji pravers ir apskaičiuojant santykinę molekulinę masę.
Santykinė molekulinė mãsė – tai molekulę sudarančių atomų santykinių atominių masių suma.
Ši masė žymima simboliu Mr (čia r reiškia „santykinis“, angl. relative).
Žinodami junginio santykinę molekulinę masę, galime apskaičiuoti elemento masės dalį junginyje. Naudosime tokią formulę:
čia ω – elemento masės dalis, Ar – elemento santykinė atominė masė, Mr – junginio santykinė molekulinė masė. Jei norime elemento masės dalį apskaičiuoti procentais, turime gautąjį rezultatą padauginti iš 100 %.
Pabandykime apskaičiuoti įvairių molekulių santykinę molekulinę masę ir jų elementų masės dalį junginyje.
1 uždavinys
Apskaičiuokime natrio chlorido santykinę molekulinę masę.
Sprendimas
Žinome, kad šio junginio formulė yra NaCl. Iš periodinės cheminių elementų lentelės matome, kad natrio santykinė atominė masė lygi 22,98977. Chloro santykinė atominė masė lygi 35,453. Kad būtų patogiau skaičiuoti, suapvalinkime šiuos dydžius iki 3 reikšminių skaitmenų.
Tada natrio masė lygi 23,0, o chloro 35,5. Šio junginio santykinė molekulinė masė lygi:
Mr(NaCl) = 23,0 + 35,5 = 58,5.
Žinome, kad NaCl yra joninis junginys, ši formulė yra empirinė, ji rodo esamą elementų santykį.
Atsakymas: 58,5.
2 uždavinys
Apskaičiuokime anglies dioksido molekulinę masę. Skaičiavimams naudokime 3 reikšminius skaitmenis.
Sprendimas
Anglies dioksido formulė yra CO2. Anglies santykinė atominė masė 12,0, deguonies – 16,0.
Mr(CO2) = 12,0 + 2 · 16,0 = 44,0.
Atsakymas: 44,0.
3 uždavinys
Apskaičiuokime anglies masės dalį anglies dioksido molekulėje.
Sprendimas
Iš ankstesnio skaičiavimo žinome, kad anglies dioksido santykinė molekulinė masė lygi 44,0. Anglies santykinė atominė masė lygi 12,0. Vadinasi,
Pastaba. Rezultatą suapvalinome iki trijų reikšminių skaitmenų.
Atsakymas: 0,272.
4 uždavinys
Apskaičiuokime aliuminio masės dalį aliuminio oksido junginyje Al2O3 ir išreikškime ją procentais.
Sprendimas
Iš pradžių apskaičiuokime junginio Al2O3 santykinę molekulinę masę:
Mr(Al2O3) = 2 · 27,0 + 3 · 16,0 = 102.
Dabar, naudodamiesi pirmiau pateikta formule, apskaičiuokime procentinę aliuminio masės dalį:
Klausimai ir užduotys
- Paaiškinkite, kas yra santykinė molekulinė masė. Kaip ji apskaičiuojama? Koks yra šios masės matavimo vienetas?
- Apskaičiuokite junginio MgCl2 santykinę molekulinę masę.
- Apskaičiuokite procentinę anglies dalį junginyje CCl4.
- Alotropinės anglies atmainos santykinė molekulinė masė lygi 864. Nustatykite šios medžiagos molekulės formulę.
- Junginio, kurio formulė yra XO3, molekulinė masė lygi 80. Elementas X yra:
- Silicis
- Siera
- Anglis
- Toliau pateiktos cheminių junginių poros. Apskaičiuokite kiekvieno junginio santykinę molekulinę masę ir nurodykite, kurio junginio santykinė molekulinė masė didesnė.
- Na2S ar NH3;
- CO ar C4H10.
Ko išmokome?
- Atominiu masės vienetu vadinamas dydis, lygus
\frac{1}{12} anglies izotopo 12C masės. - Santykinė molekulinė masė – tai molekulę sudarančių atomų santykinių atominių masių suma.
- Siekdami apskaičiuoti elemento masės dalį junginyje, turime elemento santykinę atominę masę padalyti iš junginio santykinės molekulinės masės. Norint paversti procentais, gautą rezultatą reikia padauginti iš 100 %.
