Orbitãlė, elektrònų slúoksnis, pagrindinis kvántinis skaičius, s ir p orbitãlių fòrma, sukinỹs, priešingų sukinių elektrònai.
Kvantinis atomo modelis: orbitalės
N. Boro pasiūlytas atomo modelis vaizdus. Lengva įsivaizduoti atomą kaip mažytę Saulės sistemą. Elektronai, tarsi mažos planetos, skrieja aplink savo saulę – branduolį. Tačiau iš tiesų elektrono savybės gerokai sudėtingesnės:
- Elektronas turi ir dalelių, ir elektromagnetinių bangų savybių.
- Tikslios elektrono padėties atome nustatyti neįmanoma.
Orbitalė
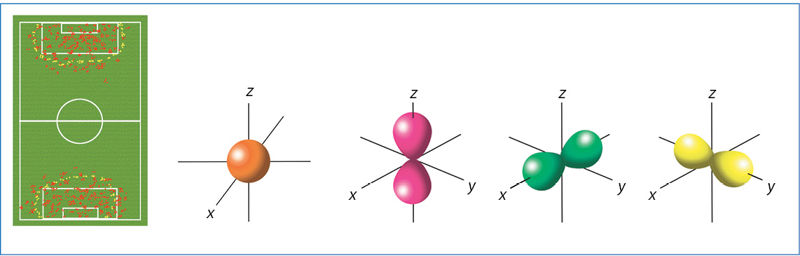
Planetos aplink Saulę skrieja tiksliai apibrėžta orbita, planetų trajektorija tiksliai apskaičiuojama ir žinoma. Kadangi tikslios elektrono padėties nustatyti neįmanoma, nelabai tikslu vartoti orbitos sąvoką elektronams. Vietoj žodžio „orbita“ vartojame žodį „orbitalė“. Nežinome, kur tiksliai yra elektronas, tad kalbame tik apie jo buvimo tikimybę. Orbitãlė – tai erdvė, kurioje elektronas būna apie 90–95 % laiko. Pasitelkime analogiją. Tarkime, per futbolo varžybas stebime vartininkų judėjimą ir kas minutę pažymime jų buvimo vietą tašku (2.5.1 pav., a). Didžiausias taškų tankis bus netoli vartų, o tolstant nuo jų taškų retės. Teritorija, kurioje vartininkas praleidžia 90–95 % viso varžybų laiko, yra vartininko „orbitalė“. Tai ne vartininko nuotrauka, o tik jo buvimo tam tikrose vietose tikimybės vaizdavimas. Jeigu galėtume tam tikrais laiko intervalais pamatyti elektroną ir pažymėti jo buvimo vietą, gautume elektrono orbitalės vaizdą. Orbitalės skiriasi savo energija, forma ir padėtimi erdvėje.
Orbitalių forma
Skirtingų formų orbitalės žymimos raidėmis s, p, d, f. Mes išsamiau aptarsime tik s ir p orbitales. Jeigu elektronas yra s orbitalėje, jo aptikimo tikimybės grafikas primena rutulio5 formos ties centru tankėjantį debesį (2.5.1 pav., b). Kiekviename sluoksnyje yra po vieną s orbitalę.
5 Rutulys, arba sfera. Žodis „sfera“ prasideda raide s. Ši sąsaja padės prisiminti, kad sferos formos orbitalė žymima raide s.
Jeigu elektronas yra p orbitalėje, jo buvimo tam tikrose vietose tikimybės grafikas primena du ištemptus rutulius abipus branduolio (2.5.1 pav., c). Galimos trys p orbitalių padėtys – x, y ir z ašyse. Pirmajame sluoksnyje p orbitalių nėra, o pradedant nuo antrojo kiekviename sluoksnyje jų yra po tris.
Sluoksnio numeris ir orbitalių skaičius
Sluoksnio numeris, arba pagrindinis kvantinis skaičius n, susijęs su orbitalių tipų skaičiumi(2.4 lentelė).
2.4 lentelė. Skaičiaus n sąsajos su orbitalių tipais ir skaičiumi
Sluoksnis | Pirmasis | Antrasis | Trečiasis | Ketvirtasis |
Pagrindinis kvantinis skaičius n | 1 | 2 | 3 | 4 |
Orbitalių tipų skaičius sutampa su n | 1 | 2 | 3 | 4 |
Sluoksnyje yra šių tipų orbitalių | s | s ir p | s, p ir d | s, p, d ir f |
Orbitalių skaičius sluoksnyje lygus n2 | 12 = 1 | 22 = 4 | 32 = 9 | 42 = 16 |
Didžiausias elektronų skaičius sluoksnyje lygus 2n2 | 2 · 12 = 2 | 2 · 22 = 8 | 2 · 32 = 18 | 2 · 42 = 32 |
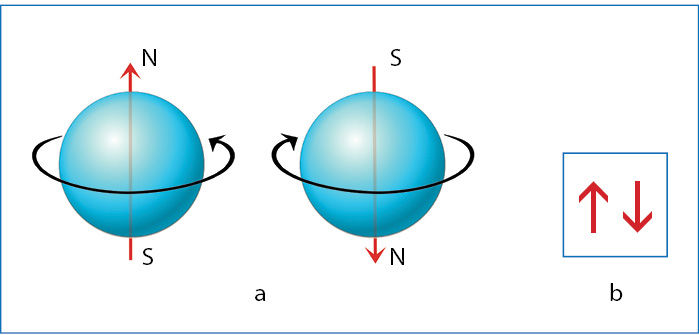
Elektrono sukinys
Kai įelektrintas kūnas sukasi aplink savo ašį, jis tampa magnetu. Įsivaizduokime elektroną kaip aplink savo ašį besisukantį rutuliuką. Jei toks rutuliukas sukasi viena kryptimi, susidaro į vieną pusę nukreiptas magnetinis laukas. Jeigu sukasi priešinga kryptimi, magnetinio lauko kryptis yra priešinga (2.5.2 pav., a). Elektronas yra ne tik neigiamąjį elektros krūvį, bet ir magnetinį lauką turinti dalelė, t. y. elektronas yra miniatiūrinis magnetas. Kai kalbama apie elektrono magnetines savybes, sakoma, kad jam būdingas sukinys. Elektronų porą sudaro vienoje orbitalėje esantys priešingų sukinių elektrònai (2.5.2 pav., b).
Klausimai ir užduotys
- Kaip susiję sluoksnio numeris ir šį sluoksnį sudarančių orbitalių tipų skaičius?
- Iš kelių ir kokio tipo orbitalių sudarytas antrasis elektronų sluoksnis?
- Kiek orbitalių yra penktajame elektronų sluoksnyje?
- Dalis elektronų sudaro elektronų poras. Kuo skiriasi vieną elektronų porą sudarantys elektronai?
- Aptarėme tik s ir p orbitalių formą. Raskite informacijos apie d ir f orbitalių formą ir šių orbitalių skaičių viename sluoksnyje.

