Atomo sandara
Ilgą laiką buvo manoma, kad cheminį elementą sudarančios mažiausios dalelės, atomai, yra nedalomi. Iš čia kilęs atomo pavadinimas: graikų kalba atomos reiškia „nedalomas“. Tačiau tai nėra tiesa. Dar XIX amžiaus pabaigoje britų mokslininkas Džozefas Džonas Tomsonas (Joseph John Thomson, 1856–1940) eksperimentuodamas atrado neigiamąjį krūvį turinčią atomo dalelę – elektròną.
Po kelerių metų iš Naujósios Zelándijos kilęs fizikas Ernestas Rezerfordas (Ernest Rutherford, 1871–1937) įrodė, kad atomą sudaro teigiamąjį krūvį turinčios dalelės – protònai. Tai atomo branduolỹs, apie kurį skrieja neigiamosios dalelės – elektronai (2.2.1 pav.).
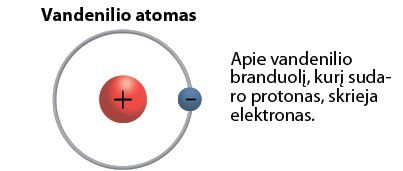
Cheminio elemento atomą sudaro branduolys ir elektronai.
Atomo protonų skaičius visada lygus elektronų skaičiui. Kadangi atsvarą teigiamojo krūvio protonams sudaro tiek pat neigiamojo krūvio elektronų, pats atomas krūvio neturi – yra neutralus.
Atomo protonų skaičius lemia, kuriam cheminiam elementui yra priskiriamas tas atomas.
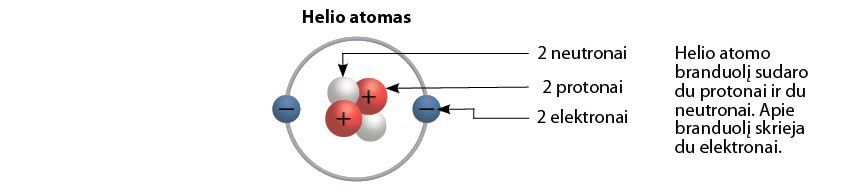
Pavyzdžiui, vandenilio atomas turi vieną protoną ir vieną elektroną. Helio atomas – du protonus ir tiek pat elektronų. Ličio atomas – tris protonus ir tris elektronus.
E. Rezerfordas taip pat įrodė, kad elemento atomo branduolyje, be teigiamąjį krūvį turinčių protonų, yra ir neutralių dalelių – neutrònų.
Elemento atomo branduolį sudarančių protonų ir neutronų skaičius gali skirtis.
Tai įdomu!
E. Rezerfordas (2.2.2 pav.) gimė Naujójoje Zelándijoje, kuri tuomet buvo Didžiósios Britãnijos kolonija. Jis užaugo 12 vaikų šeimoje. Kadangi E. Rezerfordas puikiai išlaikė egzaminus, jis gavo stipendiją studijoms koledže. Vėliau jaunasis genijus tęsė mokslus Naujosios Zelandijos universitete.
Išvykęs į Kembridžo universitetą (Didžióji Britãnija), E. Rezerfordas pradėjo dirbti Dž. Dž. Tomsono mokslininkų grupėje. Mokslinius tyrinėjimus tęsė Makgilio universitete (Kanadà), tapo šio universiteto fizikos profesoriumi. Tyrinėjo elementų radioaktyvumą, atrado protonus, neutronus, sukūrė cheminių elementų numeracijos sistemą ir padarė daug svarbių mokslinių atradimų. Jo vardu pavadintas 104-asischeminis elementas rezerfordis, žymimas simboliu Rf. Už tokius svarbius atradimus mokslininkas apdovanotas Nobelio premija.

Taigi atomas sudarytas iš protonų, neutronų ir elektronų, kurie vadinami elementariósiomis dalẽlėmis.
Tai įdomu!
Elektronai yra nutolę nuo branduolio didžiuliu atstumu. Apskaičiuota, kad atomo spindulys yra apie 1 · 10–10 m, o jo branduolio spindulys yra 1 · 10–15 m. Taigi atstumas tarp elektrono ir branduolio yra net 100 000 kartų didesnis negu atomo branduolio spindulys.
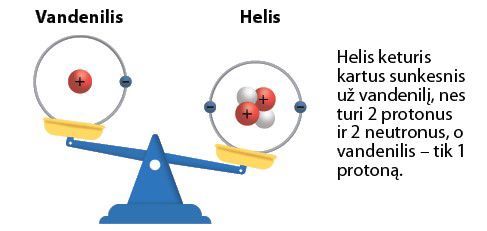
Palyginkime dviejų elementų – vandenilio ir helio – atomų modelius. Vandenilio atomą sudaro tik vienas protonas ir vienas elektronas (2.2.1 pav.). Kitokia yra helio atomo sandara – jo branduolyje yra du protonai ir du neutronai, o aplink branduolį skrieja du elektronai (2.2.3 pav.).
Atomo masės ir atominis skaičiai
Skiriasi ne tik elementariųjų dalelių krūvis, bet ir masė. Sunkiausi yra protonai ir neutronai, sveriantys vienodai, o elektronai beveik 2000 kartų lengvesni už protonus (2.2.1 lentelė).
2.2.1 lentelė. Protonų, neutronų ir elektronų palyginimas
Dalelė | Protonas | Neutronas | Elektronas |
Kur yra? | Branduolys | Branduolys | Skrieja apie branduolį |
Krūvis | +1 | 0 | –1 |
Masė (santykiniais vienetais) | 1 | 1 | 1/1836 |
Kaip matyti iš 2.2.1 lentelės, beveik visa atomo masė sukaupta branduolyje, nes elektronas yra daug lengvesnis už branduolį. Vadinasi, helio atomas dėl jame esančių dviejų protonų ir dviejų neutronų bus net keturis kartus sunkesnis už vandenilio atomą, kurio branduolį sudaro tik vienas protonas.
Grįžkime prie periodinės elementų lentelės. Kaip matome, elementai joje sunumeruoti didėjimo seka. Ką reiškia šie elementų numeriai?
Elemeñto eilės nùmeris (atòminis skaičius) reiškia protonų skaičių to elemento atomo branduolyje.
Akivaizdu, kad atomas turės tiek pat elektronų, kiek yra protonų.
Jau žinote, kad atòmo mãsę lemia sunkiosios dalelės – protonai ir neutronai. Elektronai tokie lengvi, jog į jų masę galima neatsižvelgti.
Skaičiuojant atomo masę sudedama protonų ir neutronų masė. Protonų ir neutronų masių suma vadinama mãsės skaičiumi (2.2.5 pav., a).
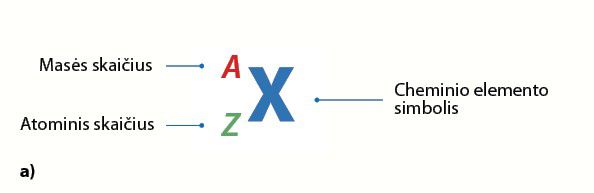
Pavyzdžiui, deguonies atomas žymimas (2.2.5 pav., b). Tai reiškia, kad deguonies atominis skaičius (deguonies eilės numeris periodinėje lentelėje) lygus 8. Vadinasi, šis atomas turi 8 protonus. Deguonies masės skaičius lygus 16. Neutronų skaičių randame iš masės skaičiaus (16) atėmę atominį skaičių (8), t. y. 16 – 8 = 8.

Tai įdomu!
Atradus elektroną, protoną ir neutroną, ilgai buvo manoma, kad šios dalelės dar smulkiau neskaidomos. XX amžiaus pabaigoje sukurtas Standartinis modelis – teorija, kuria remiantis, esama dar smulkesnių dalelių negu protonas, neutronas ir elektronas. Šveicãrijoje, šalia Ženèvos miesto, po žeme pastatytas didžiausias pasaulyje elementariųjų dalelių greitintuvas. Greitintuvą, užpildytą skystuoju heliu, sudaro 27 km ilgio žiedinis tunelis, kuriame įrengti magnetai (2.2.6 pav.). Mokslininkai, atlikdami eksperimentus, įrodė, kad visi teiginiai apie dar mažesnes daleles turi pagrindą. Kadangi tokie tyrimai labai brangūs ir vienos šalies pastangų nepakanka, įkurta Euròpos branduolinių tyrimų organizacija (CERN). Lietuvà CERN veikloje dalyvauja nuo 2018 metų.

Klausimai ir užduotys
- Kokios dalelės sudaro atomą? Kodėl jis negali būti vadinamas nedalomu?
- Atomas turi 26 elektronus. Kiek jame yra protonų? Ką reikia žinoti, norint nustatyti neutronų skaičių?
- Atomo masės skaičius lygus 7. Nustatykite, kiek šis atomas turi protonų ir neutronų, jei jame yra 3 elektronai.
- Anglies atomas turi 6 protonus. Kiek neutronų yra šio atomo branduolyje, jei anglies atomo masės skaičius lygus 12?
Ko išmokome?
- Cheminio elemento atomą sudaro branduolys ir elektronai. Neutraliojo atomo protonų skaičius visada lygus elektronų skaičiui.
- Atomo protonų skaičius lemia, kuriam cheminiam elementui yra priskiriamas tas atomas.
- Elemento eilės numeris (atominis skaičius) reiškia protonų skaičių to elemento atomo branduolyje.
- Branduolį sudaro protonai ir neutronai. Neutronų ir protonų skaičius gali skirtis.
- Protonas, elektronas ir neutronas vadinami elementariosiomis dalelėmis.
- Skaičiuojant atomo masę sudedama protonų ir neutronų masė. Į elektronų masę galima neatsižvelgti.
- Protonų ir neutronų masių suma vadinama masės skaičiumi.
- Elemento atomo simbolis gali būti užrašomas kaip
X Z A X
