Izotopai
Sužinojome, kad atomo protonų skaičius lemia, kokiam elementui priskiriamas šis atomas. Tačiau to paties elemento atomai gali turėti vienodą protonų skaičių, bet skirtingą neutronų skaičių.
Atomai, kurie turi tą patį protonų skaičių, bet skirtingą neutronų skaičių, vadinami izotòpais.
Žodis „izotopas“ kildinamas iš graikų kalbos žodžių isos – „lygus“ ir topos – „vieta“. Izotopai yra to paties elemento atomo atmainos, besiskiriančios savo mase. Gamtoje beveik visi elementai yra izotopų mišiniai. Tik 20 gamtoje randamų elementų neturi izotopų.
Elemento izotopų atominis skaičius sutampa, skiriasi tik masės skaičius.
Panagrinėkime gamtinio vandenilio pavyzdį. Žinomi trys vandenilio izotopai: protis, deuteris ir tritis (2.3.1 pav.).
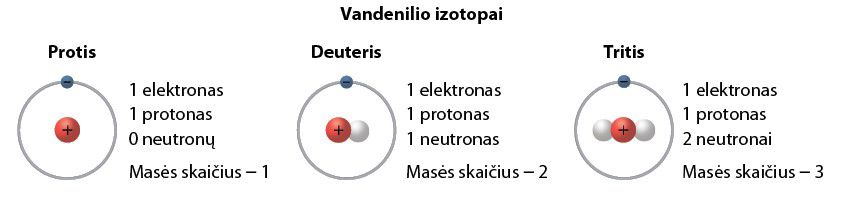
Taigi protis, deuteris ir tritis yra to paties elemento vandenilio izotopai, kurie turi vienodą protonų skaičių, bet skirtingą neutronų skaičių. Akivaizdu, kad visų šių izotopų atomų elektronų skaičius lygus – visi jie turi po vieną elektroną.
Trečiasis vandenilio izotopas tritis yra nestabilus. Jis bėgant laikui suskyla. Nustatyta, kad laikas, per kurį pusė tričio masės suskyla, lygus 12,3 metų.
Tritis yra radioaktyvus izotopas. Tai reiškia, kad skylant tričiui išsiskiria radioaktyviųjų dalelių, todėl šis izotopas labai pavojingas. Tritis naudojamas galingiausiam branduoliniam ginklui – vandenilinėms bomboms gaminti.
Tai įdomu!
Vienas iš vandenilinės bombos kūrėjų buvo Andrejus Sacharovas (Андрей Сахаров, 1921–1989) (2.3.2 pav.). Jo vadovaujama mokslininkų grupė sukūrė pačią galingiausią atominę bombą. Ji buvo susprogdinta ore 1961 m. Vėliau savo gyvenimą mokslininkas skyrė kovai už taiką ir žmogaus teises, todėl tuometės valdžios buvo nuolat persekiojamas, jam neleista gyventi Maskvojè. Už nuolatinę kovą dėl taikos ir laisvės 1975 m. jam suteikta Nobelio taikos premija. A. Sacharovas nuolat pasisakė už Lietuvõs nepriklausomybę nuo Sovietų Sąjungos, palaikė Lietuvõs Persitvarkymo Sąjūdį.

Santykinė atominė masė
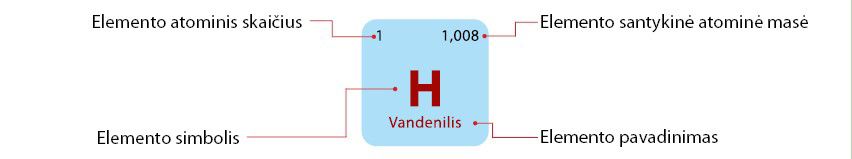
Pažvelgę į periodinę elementų lentelę pastebėsite, kad joje elementų masė pateikiama trupmeniniu skaičiumi (2.3.3 pav.), o ne sveikuoju, kaip masės skaičiaus. Kodėl? Taip nurodoma elementų santykinė atòminė mãsė (arba tiesiog atòminė mãsė). Kaip minėjome, yra tik 20 gamtoje randamų elementų, kurie neturi izotopų. Visi kiti yra izotopų mišiniai, todėl apskaičiuojant kurio nors elemento santykinę masę būtina atsižvelgti į visus jo izotopus.
Skaičiuojant elemento santykinę atominę masę vertinama to elemento kiekvieno izotopo masė ir jo paplitimas gamtoje (izotopo dalis mišinyje).
Apskaičiuokime chloro santykinę atominę masę.
Chloras – tai dujų mišinys, kurį sudaro du stabilūs izotopai. Vieno masė lygi 35. Jo mišinyje apytiksliai yra 75 %. Kito izotopo masė lygi 37, jo yra apie 25 %. Taigi chloro santykinė atominė masė apskaičiuojama taip:
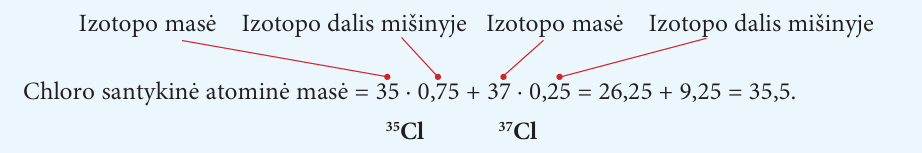
Paprastai skaičiavimo rezultatas užrašomas nustatytu reikšminių skaitmenų skaičiumi. Pavyzdžiui, čia apskaičiuota chloro santykinė atominė masė 35,5 užrašyta trimis reikšminiais skaitmenimis, periodinėje lentelėje chloro masė neretai nurodoma penkiais reikšminiais skaitmenimis – 35,453.
Pastaba. Reikšminiai skaitmenys skaičiuojami iš kairės. Jei prieš juos yra nulis, jis neįskaitomas.
Kodėl atominė masė vadinama santykine atomine mase? Atomų masė per maža, kad ją būtų galima nustatyti sveriant, tačiau galima palyginti, kiek kartų vieni atomai sunkesni už kitus. Visų elementų atominę masę sutarta lyginti su atòminiu mãsės vienetu (a. m. v.). Kas yra šis vienetas?
Atominiu masės vienetu pasirinkta
Kitaip tariant, periodinėje cheminių elementų lentelėje pateikiama elementų santykinė atominė masė rodo elementų atomų masės santykį su atominiu masės vienetu.
Panagrinėkime vandenilio santykinę atominę masę. Kaip jau minėjome, yra du stabilūs vandenilio izotopai – protis ir deuteris, tačiau deuterio yra kur kas mažiau negu pročio – tik 0,0312 %. Norint nustatyti vandenilio masę, reikia įvertinti ir deuterio buvimą, nes vienas iš 6420 vandenilio atomų yra deuteris. Tričio atomų yra visai mažai, jų galima nepaisyti. Be to, skaičiuojant elemento atominę masę reikia atsižvelgti ir į elektrono masę, nors jis beveik 2000 kartų lengvesnis už protoną ir neutroną. Vandenilio santykinė atominė masė yra 1,00797, t. y. šiek tiek didesnė už 1, nes yra atsižvelgta į nedidelį deuterio kiekį tarp vandenilio izotopų.
Norėdami užrašyti, apie kurį vandenilio izotopą kalbame, naudojame specialųjį žymėjimą (2.3.4 pav.).
Kaip matome iš 2.3.4 paveikslo, elemento simbolio kairėje pusėje, viršuje, rašomas to elemento izotopo masės skaičius. Kairėje, apačioje – elemento eilės numeris, arba atominis skaičius. Elemento simbolis yra H – taip parodome, kad tai tas pats vandenilis, tik skirtingi jo izotopai.
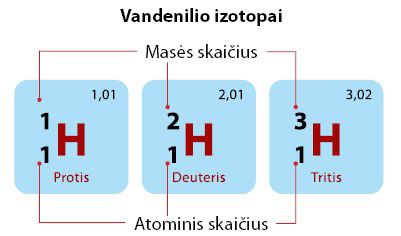
Iš šių duomenų nesunku nustatyti, kiek šio elemento izotopas turi protonų, neutronų ir elektronų.
Pabandykime nustatyti geležies izotopo protonų, neutronų ir elektronų skaičių.
Skaičius 26 yra geležies atominis skaičius. Tai reiškia, kad šio elemento atomas turi 26 protonus ir atitinkamai 26 elektronus. Kadangi geležies atomo masės skaičius lygus 56, iš jo atėmę 26 protonus, gausime neutronų skaičių (kaip minėta, į elektronų masę neatsižvelgiama): 56 – 26 = 30 neutronų.
Klausimai ir užduotys
- Ką vadiname izotopais? Kokia yra atomo branduolį sudarančių protonų ir neutronų masė ir krūvis?
- Koks yra vario atomo, turinčio 36 neutronus, masės skaičius?
- 29
- 36
- 63
- 65
- Kuri iš gretimoje lentelėje pateiktų dalelių yra natrio atomo izotopas?
- Nustatykite, kiek anglies izotopas
C 6 13 - Apskaičiuokite, kokia yra elemento ličio santykinė atominė masė, jei jį sudaro du izotopai:
Li 3 6 Li 3 7
Dalelė | Skaičius vienoje dalelėje | ||
protonų | neutronų | elektronų | |
A | 10 | 12 | 10 |
B | 11 | 12 | 10 |
C | 11 | 12 | 11 |
D | 12 | 12 | 12 |
Ko išmokome?
- Atomai, kurie turi tą patį protonų skaičių, bet skirtingą neutronų skaičių, vadinami izotopais.
- Elemento izotopų atominis skaičius sutampa, skiriasi tik masės skaičius.
- Skaičiuojant elementų santykinę atominę masę vertinama tų elementų izotopų masė ir jų paplitimas.
- Visų elementų atominė masė yra lyginama su atominiu masės vienetu. Šiuo vienetu pasirinkta
\frac{1}{12} stabilaus anglies izotopo 12C masės.
