Pirmojo periodo elementų atomų elektronų sluoksniai
Išsiaiškinome, kad elemento atomo branduolį sudaro protonai ir neutronai, o aplink branduolį skrieja elektronai. Neutraliojo atomo protonų ir elektronų skaičius sutampa, o neutronų skaičius gali skirtis.
Apie branduolį skriejantys elektronai išsidėsto elektrònų slúoksniais, arba enèrgijos lygmenimis.
Atomų elektronų sluoksniai, esantys arčiau branduolio, vadinami vidiniais elektrònų slúoksniais. Sluoksnis, pildomas elektronais, vadinamas išoriniù. Jei išoriniame elektronų sluoksnyje daugiau elektronų nebegali būti, jis laikomas užpildytu.
Vidinius elektronų sluoksnius galima įvardyti ir pagal eiliškumą: arčiausiai branduolio esantis sluoksnis bus pirmasis elektronų sluoksnis, einantis po jo – antrasis ir t. t. (2.4.1 pav.).
Nustatyti, kiek elektronų sluoksnių turi cheminio elemento atomas, galima pažvelgus į periodinę elementų lentelę. Sluoksnių skaičių rodo elemento periodo numeris. Pirmojo periodo elementų atomai turi vieną elektronų sluoksnį, antrojo – du, trečiojo – tris ir t. t.
Praėjusiose temose susipažinome su vandenilio ir helio atomų modeliais. Tai – pirmojo periodo elementai, todėl jų atomų elektronai išsidėstę viename sluoksnyje. Jei atomo pirmajame sluoksnyje yra 2 elektronai, jis laikomas užpildytu. Tokį elektronų sluoksnį turi helio atomas (2.2.3 pav.). Helio atomas yra labai stabilus, jis nesudaro jokių junginių.
Pirmasis elektronų sluoksnis laikomas užpildytu, kai jame yra du elektronai.
Antrojo periodo elementų atomų elektronų sluoksniai
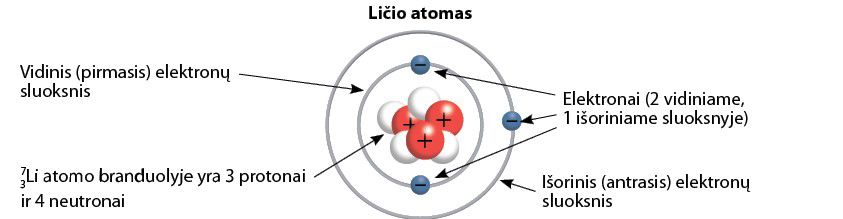
Dabar panagrinėkime daugiau elektronų sluoksnių turintį ličio atomą. Ličio atominis skaičius (jo eilės numeris periodinėje lentelėje) yra 3. Vadinasi, jo branduolyje yra 3 teigiamąjį krūvį turintys protonai, o apie branduolį skrieja 3 neigiamąjį krūvį turintys elektronai. Pats atomas yra neutralus. Ličio atomo masės skaičius yra 7, jo branduolyje yra 3 protonai ir 4 neutronai.
Piešdami šio atomo elektronų padėtį, elektronus išdėstome ne viename sluoksnyje, kaip vandenilio ir helio atveju, o dviejuose (litis – antrojo periodo elementas). Pirmajame sluoksnyje gali būti tik 2 elektronai. Taigi trečiasis ličio atomo elektronas užima naują, antrąjį, elektronų sluoksnį (2.4.1 pav.).
Tai įdomu!
Elektronai gali pereiti iš pirmojo sluoksnio į antrąjį, tačiau tam reikia daug papildomos energijos iš išorės, pavyzdžiui, pakaitinti. Vėliau, kai suteikta energija išspinduliuojama, elektronai grįžta į savo ankstesnius sluoksnius, bet tik ten, kur yra vietos. Taip ličio junginiai nudažo liepsną ryškiai raudona spalva. Ši ličio junginių savybė naudojama gaminant fejerverkus (2.4.2 pav.).

Nuosekliai einant antruoju periodu į dešinę, kiekvieno tolesnio elemento atomas turi vienu protonu ir vienu elektronu daugiau. Taigi berilio atomas turi 4 elektronus, boro – 5, anglies – 6, azoto – 7, deguonies – 8, fluoro – 9 ir neono – 10 elektronų. Kiekvieno šių elementų pirmajame elektronų sluoksnyje yra po 2 elektronus, o antrajame sluoksnyje litis turi 1 elektroną, berilis – 2, boras – 3, anglis – 4, azotas – 5, deguonis – 6, fluoras – 7 ir neonas – 8. Antrojo periodo elementų atomų elektronų išsidėstymas pavaizduotas 2.4.3 paveiksle.
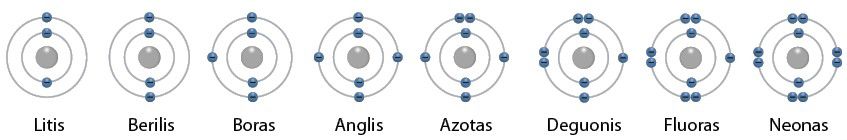
Kaip matome iš 2.4.3 paveikslo, visų šių elementų atomų pirmajame sluoksnyje yra po du elektronus, o antrajame kiekvienas paskesnis elementas turi vienu elektronu daugiau.
Antrojo periodo elementų atomų išorinis elektronų sluoksnis laikomas užpildytu tada, kai jame yra 8 elektronai.
Atomai, turintys užpildytą išorinį elektronų sluoksnį, yra stabilesni. Tarp antrojo periodo elementų tokį užpildytą išorinį sluoksnį turi neono atomas. Todėl neonas yra labai stabilus, nesudaro jokių junginių.
Trečiojo periodo elementų elektronų sluoksniai
Pereikime prie trečiojo periodo elementų – jų atomų elektronai skrieja trimis elektronų sluoksniais. Pirmasis šio periodo elementas yra natris. Jo eilės numeris yra 11. Vadinasi, jo atomas turi 11 protonų ir 11 elektronų. Pirmajame šio atomo elektronų sluoksnyje 2 elektronai, antrajame – 8, o trečiajame – vienas. Toliau einant periodu į dešinę, kiekvieno paskesnio elemento atomo išoriniame elektronų sluoksnyje padaugėja vienu elektronu (2.4.4 pav.).
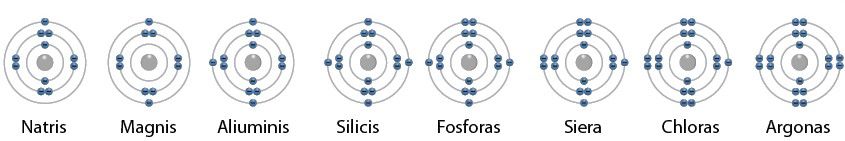
Trečiojo periodo atomų elektronų sluoksnis laikomas užpildytu, kai jame yra 8 elektronai.
Pereikime prie ketvirtojo periodo elementų, kurių atomų elektronai pradeda pildyti ketvirtąjį elektronų sluoksnį (primename – ketvirtasis periodas, vadinasi, pildomas ketvirtasis elektronų sluoksnis). Pirmieji du šio periodo elementai yra kalis ir kalcis. Kalio atominis skaičius lygus 19, o kalcio – 20. Jų atomų elektronų išsidėstymas pavaizduotas 2.4.5 paveiksle.

Kaip matyti iš 2.4.5 paveikslo, 18 šių elementų atomų elektronų yra pirmuosiuose trijuose elektronų sluoksniuose. Ketvirtajame sluoksnyje kalio atomas turi 1 elektroną, kalcio atomas – 2.
Kitų šio periodo elementų atomų, pradedant skandžiu, elektronų sluoksniai pildomi kiek kitaip. Todėl ketvirtasis periodas apima ne 8, o 18 elementų. Net 10 jų yra pereinamieji metalai, turintys gana panašių savybių. Apie šio periodo elementų atomų elektronų sluoksnių pildymą sužinosite vyresnėse klasėse.
Tai įdomu!
Apie elementų atomų elektronų išsidėstymą sluoksniais pirmasis paskelbė garsus danų mokslininkas Nilsas Boras (Niels Bohr, 1885–1962) (2.4.6 pav.). Jis gilinosi į atomo sandarą ir padėjo kvantinės teorijos pagrindus. Už šiuos darbus 1922 m. jam suteikta Nobelio premija. N. Boras buvo aktyvus taikos šalininkas, smerkė II pasaulinį karą ir žydų genocidą, todėl jam teko slapstytis nuo nacių persekiojimo. Šio mokslininko garbei 107-asis cheminis elementas pavadintas boriu (Bh).

Klausimai ir užduotys
- Ką vadiname vidiniu ir išoriniu elektronų sluoksniu? Kada elektronų sluoksnis būna užpildytas? Kurie atomai yra stabilesni – turintys užpildytą ar neužpildytą išorinį elektronų sluoksnį?
- Kiek daugiausia elektronų gali turėti trečiojo periodo cheminis elementas?
- 8
- 10
- 18
- 20
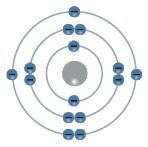
- Pažvelkite į toliau pateiktą paveikslą ir pagal nupiešto atomo elektronų išsidėstymą nustatykite, koks tai cheminis elementas. Kiek protonų ir neutronų turi šis atomas, jei jo masės skaičius lygus 31?
- Kurioje šios lentelės eilutėje pateiktas apibūdinimas būdingas tik sieros atomui?
Atomo elektronų sluoksnių skaičius | Elektronų skaičius išoriniame elektronų sluoksnyje | |
A | 2 | 6 |
B | 3 | 6 |
C | 3 | 16 |
D | 4 | 16 |
- Auksas yra šeštojo periodo 79-asis elementas. Jo atomo masės skaičius lygus 197. Nustatykite, kiek šio elemento atome yra protonų, neutronų ir elektronų. Kiek elektronų sluoksnių turi aukso atomas? Kurie jo sluoksniai yra vidiniai, kurie – išoriniai?
Ko išmokome?
- Periodo numeris rodo elemento atomo elektronų sluoksnių skaičių.
- Pirmasis elektronų sluoksnis yra užpildytas tada, kai jame yra du elektronai.
- Antrojo periodo elementų atomų išorinis elektronų sluoksnis laikomas užpildytu, kai jame yra 8 elektronai.
- Trečiojo periodo atomų elektronų sluoksnis laikomas užpildytu, kai jame yra 8 elektronai.
- Atomų elektronų sluoksniai, esantys arčiau branduolio, vadinami vidiniais elektronų sluoksniais. Sluoksnis, pildomas elektronais, vadinamas išoriniu. Jei išoriniame elektronų sluoksnyje daugiau elektronų nebegali būti, jis laikomas užpildytu.
- Atomai, turintys užpildytą išorinį elektronų sluoksnį, yra stabilesni.

