Dalelės – „kulkos“
1909 m. E. Rezerfordas suplanavo bandymą, kurio rezultatai turėjo patvirtinti arba paneigti Dž. Dž. Tomsono atomo modelį. Vis dėlto jis spėjo, kad atomas yra sudėtingesnės struktūros, negu tuomet buvo žinoma: taip manyti jį paskatino elektronų ir jo paties prieš dešimtį metų atrastų alfa (α) dalelių egzistavimas. Álfa dalẽlės – tai tūkstančius kartų už elektroną masyvèsnės teigiamojo krūvio dalelės, dideliu greičiu išlekiančios iš medžiagos, kuri savaime jas skleidžia. Prieš metus E. Rezerfordas galutinai įsitikino, kad alfa dalelės – iš dviejų protonų ir dviejų neutronų sudaryti helio atomo branduoliai, kurių krūvis savo didumu lygus dvigubam elektrono krūviui. Taip pat jis pastebėjo, kad šios dalelės, atsimušusios į fluorescúojančiąja mẽdžiaga (švỹtalu) padengtą ekraną, sukelia blyksnį. Fluoresceñcija – kai kurių medžiagų švytėjimas, gavus energijos.
Juodosios dėžės tyrimas
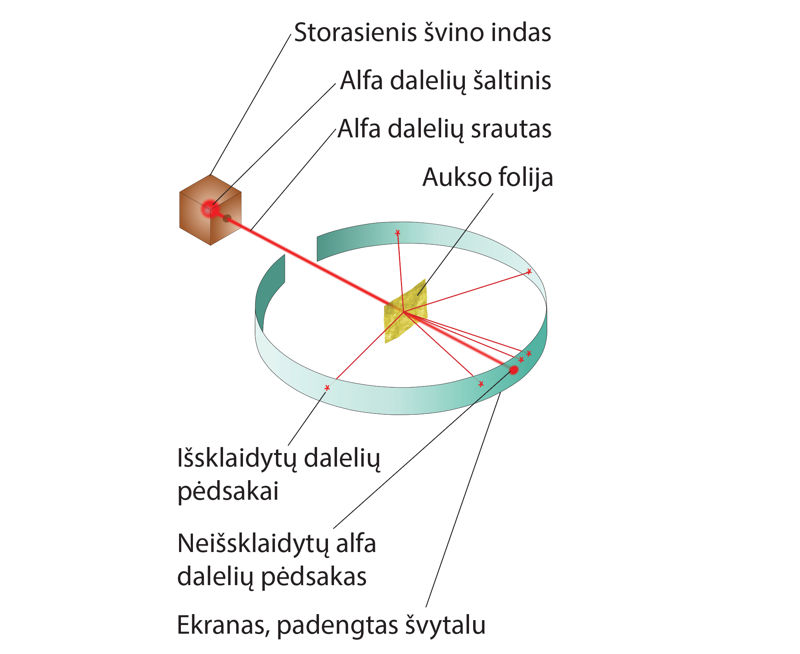
Tyrinėdamas, kaip medžiaga išsklaido α daleles, E. Rezerfordas sumanė „peršviesti atomą α spinduliais“ – ploną aukso foliją apšaudyti α dalelėmis. Iš to, kaip dalelės skverbsis pro aukso atomų sluoksnį, būtų galima spręsti apie atomo sandarą. Vaizdžiai tariant, jis susiruošė šaudyti šratais į lėktuvo juodąją dėžę ir bandyti nustatyti, kas joje yra. 6.4.1 paveiksle pavaizduota paties mokslininko sugalvoto šio bandymo įrenginio schema. Įrenginį sudarantys elementai buvo įmontuoti į stiklinę kolbą ir iš jos išsiurbtas oras. Savaime spinduliuojančio cheminio elemento skleidžiamas α dalelių pluoštelis, praėjęs pro tarpą ekrane ir labai ploną (0,1 μm storio) aukso foliją, atsimuša į ekraną. Padidintas aukso folijos pjūvio vaizdas bandymo metu pavaizduotas 6.4.2 paveiksle.
Samprotavimai ir nuostaba
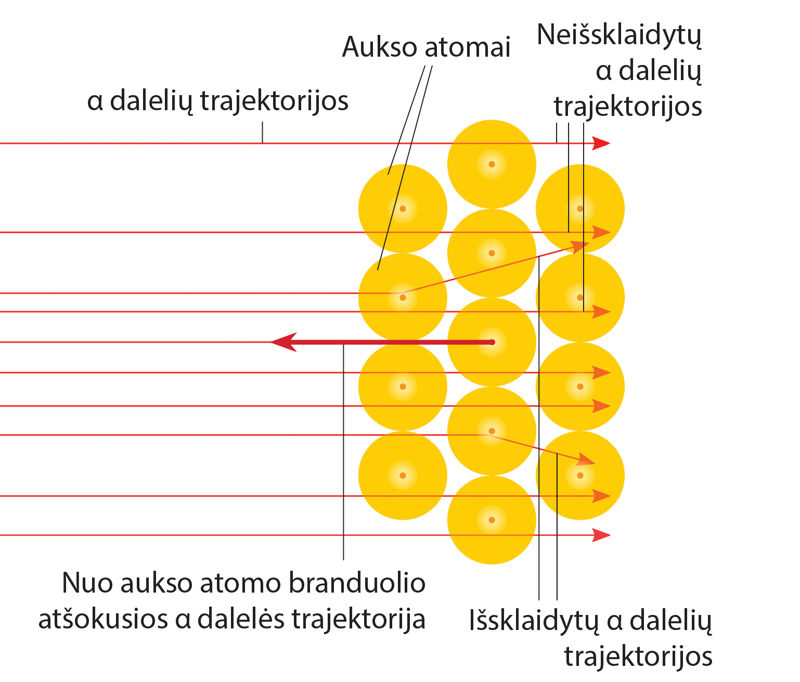
E. Rezerfordui buvo visiškai suprantama, kad dauguma α dalelių pralekia pro aukso atomus kiaurai – ekrane matoma dėmė, sudaryta iš daugybės švytinčių taškelių. Jį stebino, kad kai kurios dalelės labiau nukrypsta nuo tiesaus kelio – apie tai byloja retesni blyksniai ekrano kraštuose, o glumino, kad viena kita dalelė tiesiog atšoka nuo folijos ir grįžta atgal (6.4.2 pav.). Tai buvo akivaizdu, stebint retus ekrano blyksnius beveik priešinga alfa dalelių skriejimo kryptimi. „Buvo beveik tiek pat neįtikėtina, kaip kad šovus į plono popieriaus lapą 15 colių sviediniu, jis atšoktų ir pataikytų į jus“ – maždaug taip mąstė tyrėjas. Mokslininkui gimė neišvengiama mintis: atome yra masyvi, koncentruoto teigiamojo krūvio šerdis. Ji ir stoja neįveikiama kliūtimi teigiamosioms α dalelėms, lekiančioms dešimčių tūkstančių kilometrų per sekundę greičiu. Šerdis labai maža, tad reta dalelė pataiko į ją kaktomuša, kad atšoktų. Taip neginčijamai buvo įrodyta, jog atomas turi branduolį.
E. Rezerfordo bandymo išvados
- Didžioji atomo tūrio dalis (≈ 99,9 %) yra tuštuma – dauguma α dalelių pralekia pro aukso foliją, nepakeitusios krypties.
- Beveik visa atomo masė (≈ 99,5 %) ir visas jo teigiamasis krūvis su telkti jo šerdyje – atomo branduolyje.
- Elektronai skrieja aplink branduolį orbitomis kaip planetos aplink Saulę.
Tobulo modelio iliuzija
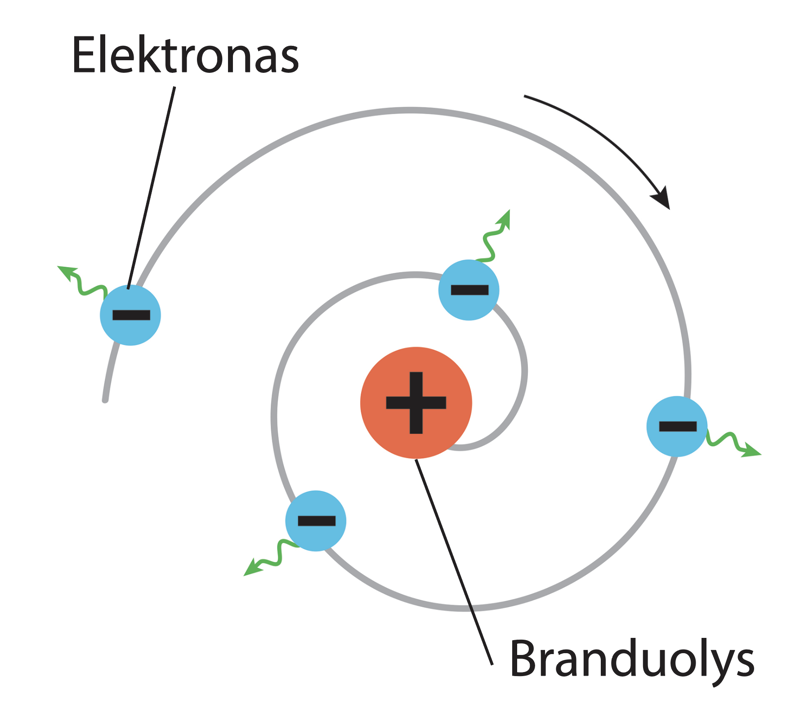
Kiekvienas mokslininkas svajoja sukurti tobulą teoriją ar modelį. Ne išimtis ir E. Rezerfordas. Kruopščiai patikrinęs aprašyto bandymo rezultatus, jis paskelbė: „Dabar žinau, kaip atrodo atomas!“ Mokslininkui jis atrodė kaip mažytė Saulės sistema su teigiamuoju branduoliu centre ir neigiamaisiais elektronais tolimose planetų orbitose. Tačiau E. Rezerfordas labai greitai suprato, kad tai, kaip atrodo, gali skirtis nuo to, kaip yra iš tikrųjų. Pagal tuo metu žinotus dėsnius atomas negalėjo būti taip sudarytas: elektronai skriedami turėtų be paliovos spinduliuoti energiją ir, jos netekę, nukristi ant branduolio (6.4.3 pav.). Jei taip nutiktų, atomas liautųsi egzistavęs.
Bet taip nenutinka. Reikėjo kurti naują teoriją, paaiškinančią, kodėl atomai nenukrinta ant branduolio. Reikėjo ir naujo atomo modelio. Čia E. Rezerfordas pasielgė kaip didis mokslininkas. Ką tik sukūręs planetinį atomo modelį, suvokė jo ribotumą. Trumpam pasirodė tik tobulo modelio miražas. Nepaisant to, buvo žengtas milžiniškas žingsnis – įrodyta tai, ko niekas anksčiau nesiėmė tvirtinti esant.
Platesniam akiračiui
Kodėl auksas?
E. Rezerfordas savo bandyme naudojo aukso foliją tikrai ne todėl, kad tai vienas iš seniausiai žmogui žinomų tauriųjų metalų. Tik kelių dešimčių atomų skersmens storio folija buvo reikalinga tam, kad taptų kuo „skaidresnė“ alfa dalelėms – būtų kuo geresnės sąlygos joms laisvai pralėkti pro kuo mažesnę atomų sangrūdą. Tokią foliją galima gauti tik iš ypač kalaus metalo. Auksas yra labiausiai kalus iš visų žinomų metalų. Jį lengva suploti ir pagaminti plonesnius negu 0,001 mm storio lakštus – tokie lakštai naudojami dekoravimui, šventyklų pastatų kupolams auksuoti ir pan. Aukso lakštus galima tiek ploninti, kad jie tampa skaidrūs ir įgauna žalsvą atspalvį. Iš vieno gramo aukso įmanoma ištempti 3 km ilgio giją, o iš vieno kilogramo pagaminta folija – padengti trijų vidutinio dydžio klasių lubų ir sienų paviršių!
N. Boras įžvelgė, kad elektronai skrieja aplink branduolį tik tam tikromis leistinomis orbitomis. Jie nenukrinta ant branduolio – atomai nesuyra – dėl to, kad visose leistinose orbitose elektronai išlieka saugiu atstumu nuo branduolio.
E. Rezerfordui sėkmingai šturmuojant atomo paslapčių viršūnes, per Kembridžą nuskriejo sparnuota vieno iš jo kolegų frazė: „Mes iš Antipodų šalies gavome laukinį triušį, ir jis kasasi giliai!“ Vėliau E. Rezerfordui, jau tapusiam brandžiu mokslininku, prigijo Krokodilo pravardė.
Klausimai ir užduotys
- Kokias daleles vadiname α dalelėmis? Kurio tai atomo branduoliai?
- Kas rodo, jog α dalelės atsimuša į švytalu padengtą ekraną?
- Kodėl dauguma α dalelių pro aukso folijos plokštelę pralekia, nepakeisdamos krypties – kiaurai?
- Kodėl sukurtas planetinis atomo modelis nebuvo tobulas?
- Kuo remdamasis E. Rezerfordas suformulavo antrąją bandymo išvadą?
- Kodėl aukso folijos atomų elektronai beveik neturėjo įtakos α dalelių sklidimui?
- Ko paklaustumėte bendraklasių, norėdami patikrinti jų žinias apie E. Rezerfordo bandymą?
- Pasvarstykite, kodėl E. Rezerfordą kolega iš Kembridžo pavadino laukiniu triušiu iš Antipodų šalies. Ieškodami informacijos internete, išsiaiškinkite, su kokia geografine vieta siejamas šis pavadinimas ir kodėl jis taip pavadintas.

