Atomo branduolys. Izotopai
Atomo branduolys yra esminis medžiagos sudedamasis elementas. Kaip jau minėta, branduolį sudaro protonai ir neutronai. Šios abi dalelės apibendrintai vadinamos nukleònais (lot. nucleus – branduolys). Protonų ir neutronų savybės yra panašios, išskyrus tai, kad neutronas neturi krūvio. Ir protono, ir neutrono masė yra maždaug 2 000 kartų didesnė už elektrono masę, todėl branduolyje sutelkta beveik visa atomo masė. Branduolio spindulys bent 10 000 kartų mažesnis už atomo spindulį, taigi branduolio tankis milžiniškas – net 1017 kg/m3. Jei branduolio tūris būtų lygus 1 cm3, jo masė siektų 100 mln. tonų!
Atominis ir masės skaičiai
Šalia cheminio elemento simbolio dažnai rašomi atòminis skaičius ir mãsės skaičius – taip nurodoma elemento atomo struktūra (6.5.1 pav.).

Atominis skaičius Z nusako protonų skaičių atomo branduolyje, elektronų skaičių neutraliame atome ir elemento eilės numerį periodinėje elementų lentelėje.
Masės skaičius A nusako nukleonų skaičių branduolyje. Jis lygus protonų skaičiaus Z ir neutronų skaičiaus N sumai.
1 pavyzdys
Anglis žymima . Jos atominis skaičius Z = 6 rodo, kad branduolyje yra 6 protonai ir aplink branduolį skrieja 6 elektronai. Masės skaičius A = 12 rodo, kad branduolį sudaro 12 nukleonų, iš jų 6 yra protonai ir 6 neutronai (N = A − Z).
Izotopai
To paties cheminio elemento atomas gali turėti atmainų. Šios atmainos vadinamos izotopais. Dauguma cheminių elementų turi bent po kelis izotopus.
Izotòpai (gr. isos – vienodas, lygus + topos – vieta) – cheminio elemento atomai, kurių branduoliuose yra toks pat protonų skaičius, bet skirtingas neutronų skaičius. Taigi izotopų branduolio krūvis vienodas, bet skirtinga atominė masė.
2 pavyzdys
Gamtoje aptinkami trys vandenilio izotopai: protis, deuteris ir tritis (6.5.2 pav.).
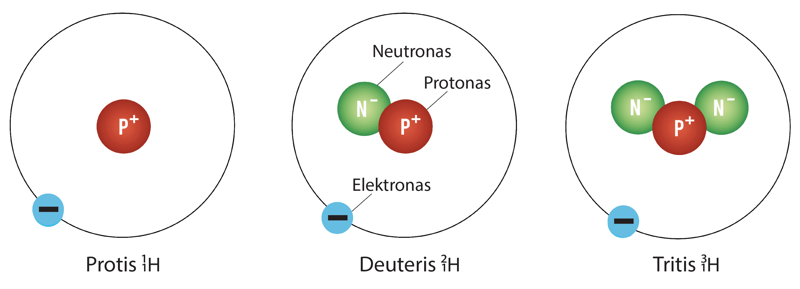
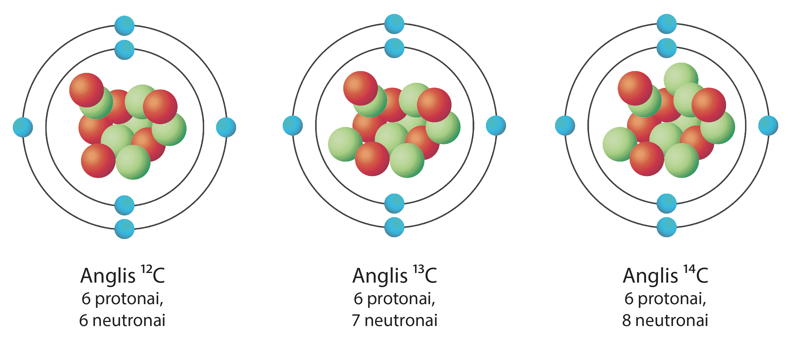
3 pavyzdys
Trijų anglies izotopų
Platesniam akiračiui
Reliatyvumas – priklausymas nuo atskaitos taško
Mums, žmonėms, metai praeina, kai kartu su Žeme vieną kartą apkeliaujame orbita aplink Saulę. Visatai, anot mokslininkų, yra apie 14 milijardų metų. Tai laikotarpis, per kurį Žemė apsisuktų aplink Saulę 14 milijardų kartų. Mums tai – tarsi amžinybė. Tarkime, elektrono Saulė – atomo branduolys. Vandenilio atome elektronas per sekundę apsisuka maždaug 10 000 milijardų kartų. Vadinasi, elektrono metai truktų 1 000 kartų trumpiau negu viena dešimtmilijardinė sekundės dalis, jis 14 milijardų kartų apsisuktų per 0,0014 sekundės. Tai ir yra reliatyvumas: elektronui 0,0014 sekundės tokia pati amžinybė, kaip mums 14 milijardų metų!
Klausimai ir užduotys
- Prisiminkite, ką vadiname protonais ir neutronais. O ką nukleonais? Suformuluokite apibrėžimus.
- Kokiomis spalvomis 6.5.3 paveiksle pavaizduoti protonai ir neutronai?
- Kuo skiriasi anglies izotopų
C 6 12 C 6 14 - Kiek elektronų skrieja aplink cinko
Zn 30 65 - Kiek protonų ir kiek neutronų yra vario
Cu 29 64 - Kurio cheminio elemento branduolyje yra 4 protonai ir 5 neutronai? Kurio – 15 protonų ir 15 neutronų?
