Mòlis, Avogãdro konstánta, atòmas, molèkulė, mòlinė mãsė, dùjų mòlinis tūris, chèminė fòrmulė.
Molis – medžiagos kiekio matas
Tarptautinėje SI matų sistemoje medžiagos kiekis išreiškiamas moliais.
Mòlis – medžiagos kiekio matas. Vieną molį sudaro 6,022 · 1023 dalelių* (molekulių, atomų, jonų, elektronų, radikalų ar kitų medžiagą sudarančių dalelių).
* Tarptautinės teorinės ir taikomosios chemijos sąjungos (IUPAC) pateikiamame apibrėžime nurodoma, kad vieną molį sudaro tiksliai 6,02214076 · 1023 dalelių. Šios dalelės gali būti atomai, molekulės, jonai, elektronai ar bet kurios kitos dalelės ar jų grupės. Toks molio apibrėžimas galioja nuo 2019 metų, tad senesniuose leidiniuose galite rasti kiek kitokį aiškinimą.
Dydis
Su molio sąvokos vartojimu susiję skaičiavimai gali būti atliekami taikant proporcijas arba matematines formules:
(1.4.1)
(1.4.2)
(1.4.3)
čia n – dalelių kiekis moliais, N – dalelių skaičius, NA – Avogadro konstanta (
Medžiagos vieno molio masė vadinama jos mòline masè (M) ir išreiškiama g/mol arba kitu ekvivalenčiu dydžiu. Avogadro konstanta parinkta taip, kad molinė masė (išreikšta g/mol) savo skaitine reikšme sutaptų su atomo arba molekulės santykine mase (1.4.1 ir 1.4.2 pav.).
1 kmol (kilomolis) = 1000 mol.
1 mmol (milimolis) = 0,001 mol.
1 µmol (mikromolis) = 1 · 10–6 mol.lis) = 0,001 mol.
1 nmol (nanomolis) = 1 · 10–9 mol.

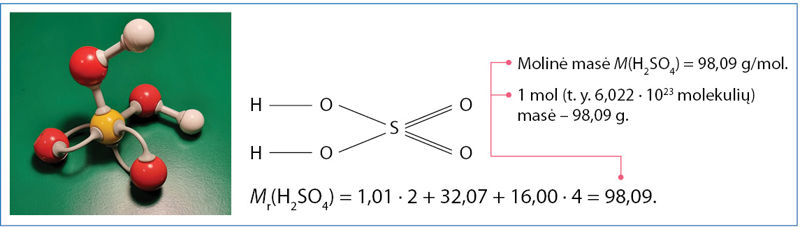
1 pavyzdys
Arbatiniame šaukštelyje yra 5,00 g vandens. Nustatykite šiame mėginyje esančių: a) vandens molekulių skaičių; b) vandenilio atomų skaičių.
Sprendimas
Išnagrinėsime du sprendimo variantus – sprendimą remiantis formulėmis ir proporcijomis.
1 variantas:
- Galime iš medžiagos masės rasti jos kiekį moliais (taikome 1.4.2 formulę), tada apskaičiuoti molekulių skaičių (taikome 1.4.1 formulę) arba šias dvi formules sujungti ir išvesti tokią formulę:
- Kadangi kiekvienoje molekulėje yra po du vandenilio atomus, jų skaičius yra:
Komentaras. Galutiniai atsakymai suapvalinti iki trijų reikšminių skaitmenų, nes vandens masė duota trimis reikšminiais skaitmenimis. Daugiklis 2 yra tikslus. Vienoje molekulėje yra tiksliai du vandenilio atomai. Šis daugiklis nekeičia reikšminių skaitmenų skaičiaus.
2 variantas:
- Taikydami proporcijas galime spręsti taip. Vandens molinė masė 18,02 g/mol rodo, kad 1 molio, tai yra 6,022 · 1023 šios medžiagos molekulių, masė lygi 18,02 g.
Sudarome proporciją:
1 mol H2O – 6,022 · 1023 molekulių | – 18,02 g, |
x molekulių | – 5,00 g; |
x = 1,6709 · 1023 ≈ 1,67 · 1023 H2O molekulių.
- Vandenilio atomų skaičius įvertinamas taip pat kaip 1-ajame variante.
Atsakymas: vandens molekulių yra 1,67 · 1023, o vandenilio atomų 3,34 · 1023.
2 pavyzdys
Apskaičiuokite vienos anglies(IV) oksido molekulės masę kilogramais.
Sprendimas
M(CO2) = 44,01 g/mol = 0,04401 kg/mol.
Sudarome proporciją:
1 mol CO2 – 6,022 · 1023 molekulių | – 0,04401 kg, |
1 molekulė | – x kg; |
x = 7,308203 · 10–26 kg ≈ 7,308 · 10–26 kg.
Atsakymas: vienos CO2 molekulės masė 7,308 · 10–26 kg.
3 pavyzdys
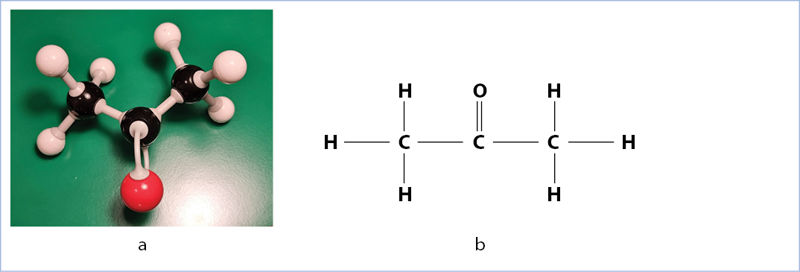
Nagų laką galima nuvalyti acetonu (1.4.3 pav.). 1,00 ml acetono sudaro 20 lašų, acetono tankis yra 0,790 g/cm3. Apskaičiuokite viename acetono laše esantį vandenilio atomų:
- kiekį moliais;
- skaičių.
Sprendimas
Pirmiausia apskaičiuosime vieno lašo acetono tūrį, tada masę ir, galiausiai, kiekį moliais. Tada išnagrinėsime acetono formulę ir nustatysime, kaip šios medžiagos molekulių kiekis susijęs su vandenilio atomų skaičiumi.
m(acetono lašo) = ρ · V = 0,790 g/cm3 · 0,0500 cm3 = 0,0395 g.
Acetono formulė pateikta 1.4.3 pav.
M(acetono) = 58,09 g/mol;
Iš acetono formulės matome, kad vienoje molekulėje yra šeši vandenilio atomai, t. y. vandenilio atomų skaičius 6 kartus didesnis už molekulių kiekį.
n(H) = 6,80 · 10–4 mol · 6 = 4,08 · 10–3 mol;
Atsakymas: a) vandenilio atomų kiekis 4,08 · 10–3 mol; b) vandenilio atomų skaičius 2,46 · 1021.
Klausimai ir užduotys
- Įsivaizduokite, kad gavote maišelį ryžių ir užduotį per kuo trumpesnį laiką ir kuo tiksliau suskaičiuoti ten esančių ryžių grūdelių skaičių. Pasiūlykite, kaip tai padaryti (nepamirškite sąlygų – kuo tiksliau ir kuo greičiau). Išbandykite pasiūlytą variantą ar variantus praktiškai.
- Aguonos grūdai labai maži. 3300 aguonos grūdų masė lygi 1,0 g, o bendras tūris – 1,4 cm3. Įsivaizduokime, kad turime 6,022 · 1023 (t. y. vieną molį) aguonos grūdų ir jais vienodo storio sluoksniu padengėme visą Lietuvos plotą (65 300 km2). Koks būtų to sluoksnio storis?

- Mėgintuvėlyje yra 0,60 g 2-propanolio CH3CH(OH)CH3 (1 pav.). Apskaičiuokite:
- 2-propanolio kiekį (moliais);
- deguonies atomų kiekį ir skaičių;
- vandenilio atomų kiekį ir skaičių.
- Apskaičiuokite vienos 2-propanolio CH3CH(OH)CH3 molekulės masę gramais.
- Viename balione yra 44 g propano, kitame – 44 g etano. Kuriame balione yra daugiau vandenilio atomų?
- Žemėje gyvena apie 8 milijardus (8,0 · 109) žmonių. Tai išties daug. Atseikėkime kiekvienam Žemės gyventojui po milijoną aukso atomų. Kokia būtų bendra visų atseikėtų aukso atomų masė?

