Radioaktỹviosios mẽdžiagos, α, β ir γ spinduliuõtė, pusėjimo trukmė, jonizãcija, spinduliuõtės skvarbà.
Radioaktyvieji skilimai
1903 m. trims mokslininkams – Antuanui Anri Bekereliui (Antoine Henri Becquerel, 1852–1908), Marijai Kiuri-Sklodovskai (Marie Curie Skłodowska, 1867–1934) ir Pjerui Kiuri (Pierre Curie, 1859–1906) – buvo įteikta Nobelio premija už radioaktyvumo atradimą ir tyrimą. Tyrimo pristatymo paskaitoje P. Kiuri kalbėjo8: „1896 m. A. H. Bekerelis atrado ypatingą urano ir jo junginių savybę. Uranas skleidžia labai silpnus spindulius, kurie veikia fotografijos plokšteles. Šie spinduliai prasiskverbia pro juodą popierių ir metalus. Orą jie padaro laidų elektros srovei. <...> 1898 m. ponia M. Kiuri įrodė, kad visos urano ir torio turinčios medžiagos skleidžia A. H. Bekerelio atrastuosius spindulius. Šias medžiagas mes pavadinome radioaktyviosiomis.“
8 Pjero Kiuri kalba „Radioaktyviosios medžiagos, ypač radis“ (Pierre Curie Radioactive Substances, Especially Radium) 1905 m. birželio 6 d. Nobelio premijos laureatų paskaitoje Stokholme, vertė Rimantas Raudonis, prieiga per internetą: https://www.nobelprize.org/prizes/physics/1903/pierre-curie/lecture/Pierre Curie – Nobel Lecture - NobelPrize.org
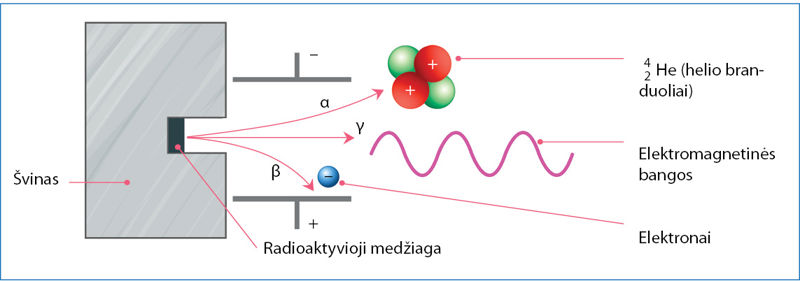
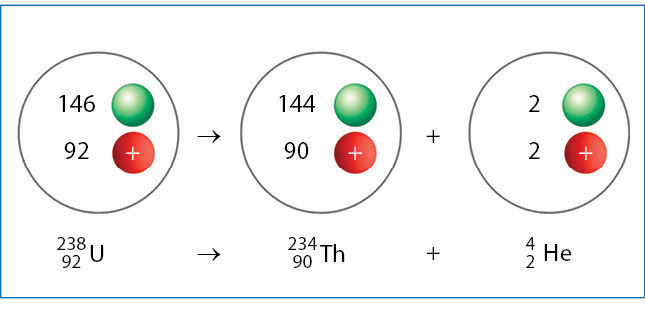
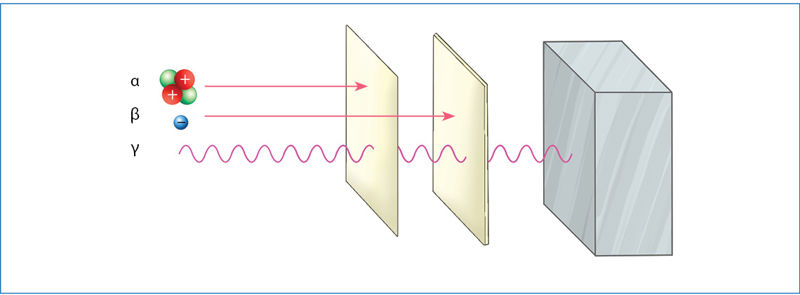
Radioaktyviųjų medžiagų skleidžiama spinduliuõtė yra trijų tipų: álfa (α), betà (β) ir gamà (γ) (2.8.1 pav.). Ji susidaro skylant urano, torio ir kai kurių kitų elementų branduoliams. Pavyzdžiui, urano
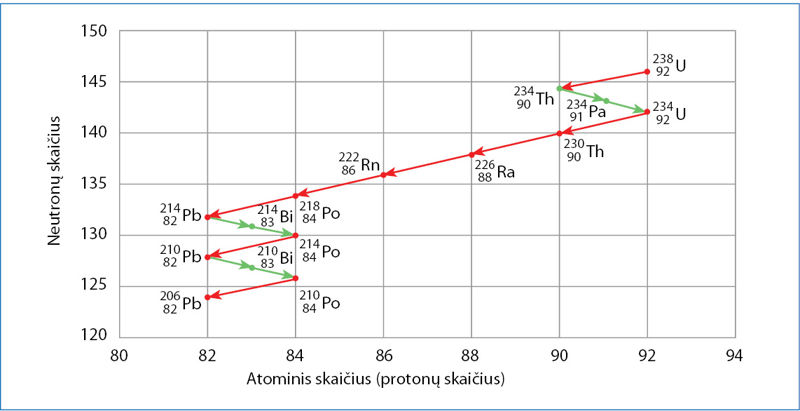
Gamtoje randama apie 340 izotopų, iš kurių 70 – radioaktyvių. Elementai, kurių atominis skaičius mažesnis už 84, turi ir patvarių, ir radioaktyvių izotopų. Pradedant 84-uoju elementu – poloniu – patvarių izotopų nebėra. Visi šio ir didesnio atominio skaičiaus izotopai yra radioaktyvūs.
Organinių iškasenų amžiaus nustatymas
Gamtoje randami trys anglies izotopai:
(2.8.1)
Susidarę anglies atomai reaguoja su deguonimi. Taip atmosferoje atsiranda radioaktyviojo anglies(IV) oksido
6CO2 + 6H2O → C6H12O6 + 6O2.
(2.8.2)
Per mitybos grandines augalų susintetintos organinės medžiagos patenka į kitus organizmus. Kol organizmas gyvas, radioaktyviosios ir patvariosios anglies kiekio santykis jame išlieka pastovus. Žuvus organizmui, šis santykis kinta, nes organinės liekanos nebepapildomos
Radioaktyviųjų izotopų naudojimas
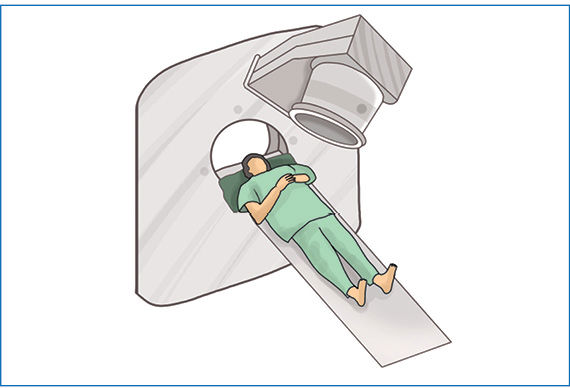
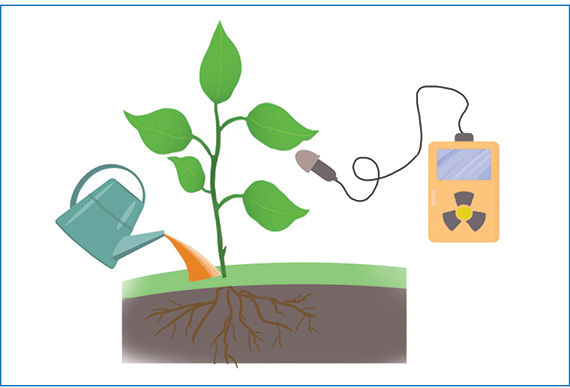
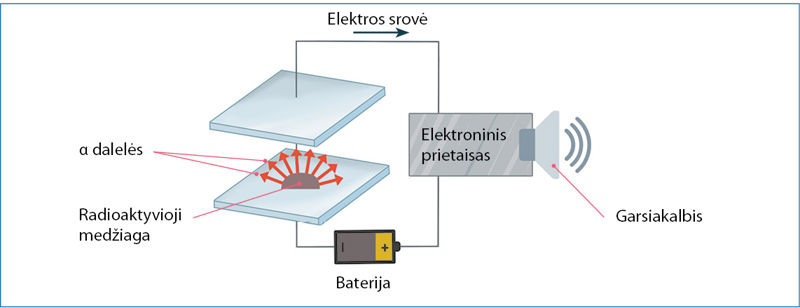
Didelės energijos radioaktyvioji spinduliuotė sąveikauja su aplinkoje esančiomis medžiagomis. Stipriausiai sąveikauja α dalelės. Jos jonizuoja medžiagų molekules – atima elektronus ir paverčia teigiamaisiais jonais. Prisijungusios elektronus α dalelės tampa helio dujomis. Dėl stiprios sąveikos α dalelės į medžiagas įsiskverbia labai negiliai. Kitų radioaktyviõsios spinduliuõtės tipų skvarbà yra didesnė (2.8.4 pav.). Radioaktyviosios spinduliuotės energijos pakanka medžiagoms jonizuoti arba net cheminiams ryšiams nutraukti. Tai ypač pavojinga gyvybei. Patekusi į organizmą radioaktyvioji spinduliuotė gali suardyti sudėtingas organines molekules ir sukelti ligas arba apskritai sunaikinti organizmą. Todėl radioaktyviųjų medžiagų saugojimas yra griežtai kontroliuojamas. Šios medžiagos laikomos specialiuose storasieniuose, dažniausiai švininiuose, induose. Laikantis saugos reikalavimų radioaktyviąsias medžiagas galima naudoti medicinoje (2.8.5 pav.), moksliniuose tyrimuose (2.8.6 pav.) ir netgi buityje (2.8.7 pav.). Radioaktyviųjų medžiagų naudojimo sąrašas būtų neišsamus, jeigu nepaminėtume atominės energetikos ir branduolinės ginkluotės. Atominėse elektrinėse naudojamas uranas-235, o atominėse bombose – urano ir plutonio izotopai.
Klausimai ir užduotys
- Nurodykite, kuri atomo dalis pakinta vykstant radioaktyviajam skilimui.
- Apibūdinkite α, β ir γ spinduliuotę.
- Periodinėje lentelėje nurodyta anglies atominė masė yra 12,01. Radioaktyviosios anglies
C 6 14
Izotopas | |||
Santykinė atominė masė | 12,000000 | 13,003354 | 14,003242 |
- Elementų izotopinė sudėtis skirtinguose dangaus kūnuose šiek tiek skiriasi nuo Žemės. Tiriant Marso atmosferą nustatyta, kad joje izotopo 13C dalis didesnė nei Žemėje. Vieno tyrimo duomenimis, Marso atmosferoje izotopo 12C paplitimas siekia 97,75 %, o 13C – 2,25 %. Naudodamiesi šioje užduotyje nurodytu izotopų paplitimu ir pateiktos lentelės duomenimis, apskaičiuokite anglies izotopų mišinio santykinę atominę masę Marso atmosferoje.
- Be gamtinių anglies izotopų, pateiktų lentelėje, žinomi dirbtiniu būdu gauti izotopai:
C 6 9 C 6 10 C 6 11 C 6 15 C 6 16 C 6 17