Bendróji elektrònų porà, kovaleñtinis ryšỹs, kovaleñtinis pòlinis ryšỹs, kovaleñtinis nepòlinis ryšỹs, elektrònų oktètas, valentingùmas, elektrinis neigiamùmas.
Kovalentinis ryšys: molekulės
Kai atomai virsta jonais, jie įgyja aštuonių elektronų rinkinį (oktetą), prisijungdami valentinius elektronus arba jų netekdami. Kitas būdas įgyti oktetą – sudaryti bendrąsias elektrònų poràs. Taip jungiasi nemetalų atomai, pavyzdžiui, sieros ir chloro. Susidaro kovaleñtinis1 ryšỹs (3.2.1 pav.). Atomai sujungti bendrąja elektronų pora. Jai sudaryti panaudojama po vieną kiekvieno sąveikaujančių atomų elektroną. Abiejų atomų branduoliai bendrąją elektronų porą traukia savęs link ir taip išlieka sujungti. Panašiai nutinka per virvės traukimo varžybas (3.2.2 pav.).
1 Priešdėlis co, arba con, kilęs iš lotynų kalbos ir reiškia „kartu, drauge“. Žodis valentia reiškia stiprumą, pajėgumą, valdymą. Tad kovalentinis reiškia „kartu valdomas“.
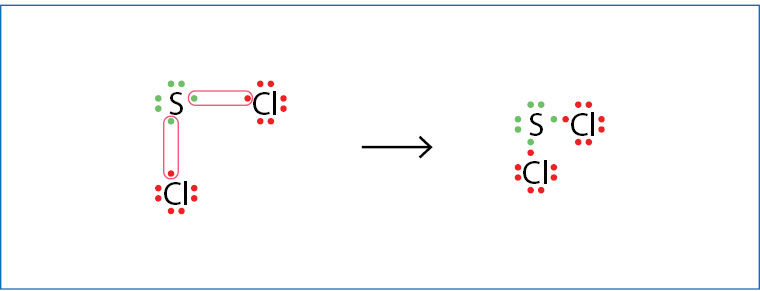

Kai nagrinėjome joninį ryšį, sakėme, kad jonai traukia vieni kitus visomis kryptimis. Kovalentinis ryšys yra kryptingas. Bendroji elektronų pora jungia tik tuos atomus, tarp kurių ji susidaro. Esant joniniam ryšiui, traukos ir stūmos jėgos apima visą kristalą, nėra fiksuoto skaičiaus, kiek jonų gali sąveikauti. Kai susidaro kovalentinis ryšys, atomas sudaro tik tam tikrą baigtinį bendrųjų elektronų porų skaičių. 3.2.1 paveiksle matome, jog siera sudaro dvi bendrąsias poras (yra dvivalentė), o chloras – tik vieną (yra vienvalentis).
1 pavyzdys
Luiso elektroninėmis formulėmis parodykite kovalentinių ryšių susidarymą amoniako NH3 molekulėje.
Sprendimas
Azotas turi penkis valentinius elektronus, vandenilio atomai – po vieną.
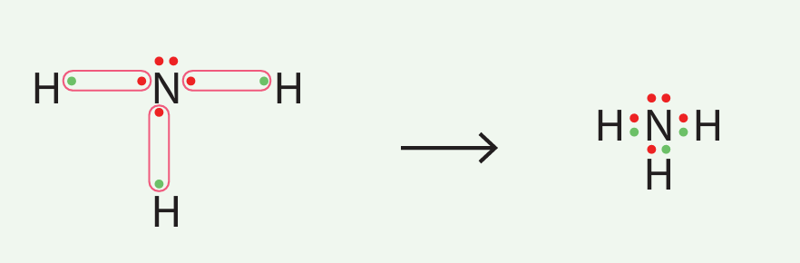
Elektrinis neigiamumas
Atomų geba pritraukti kito atomo elektronus apibūdinama elektriniù neigiamumù. Ši atomų savybė tiesiogiai neišmatuojama, todėl sudarytos net kelios elektrinio neigiamumo skalės. Dažniausiai naudojama keturbalė skalė (žr. 13 priedą). Silpniausiai elektronus traukiančių šarminių metalų elektrinis neigiamumas yra apie vienetą. Jie silpnai laiko savo valentinius elektronus, reaguodami juos praranda ir virsta teigiamaisiais jonais. Stipriausiai svetimus elektronus traukia fluoras – jo elektrinis neigiamumas apytiksliai lygus keturiems. Fluoras elektronus tik prisijungia ir virsta neigiamuoju jonu. Nė vienas elementų nepajėgia atimti elektronų iš fluoro atomo.
Kovalentinio ryšio poliškumas
Palyginkime kovalentinius ryšius chloro Cl2 ir vandenilio chlorido HCl molekulėse (3.2.3 pav.). Susijungusių atomų elektrinio neigiamumo skirtumas chloro molekulėje lygus nuliui, o vandenilio chlorido molekulėje lygus vienetui. Nors abiem atvejais cheminiai ryšiai yra kovalentiniai, jų savybės skiriasi. Du susijungę chloro atomai bendrąją elektronų porą traukia vienoda jėga. Ši pora yra išsidėsčiusi simetriškai abiem susijungusiems atomams. Todėl elektros krūvis molekulėje pasiskirstęs simetriškai, tolygiai. Vandenilio chlorido molekulėje chloro atomas elektronų porą traukia stipriau ir prisitraukia ją arčiau savęs. Todėl elektros krūvis molekulėje pasiskirstęs nesimetriškai, netolygiai. Prie chloro atomo neigiamojo elektros krūvio sukaupta daugiau, mat jis bendrąją elektronų porą pritraukė arčiau savęs. O vandenilio atomas dėl to turi teigiamojo krūvio persvarą. Kovalentinis ryšys tarp vandenilio ir chloro yra pòlinis, o tarp dviejų chloro atomų – nepòlinis.
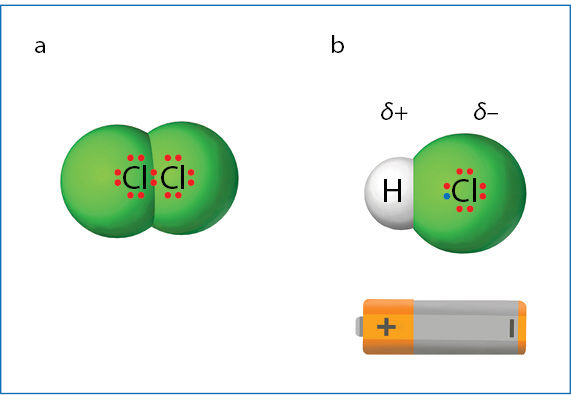
Kovalentinis ryšys yra nepolinis, jeigu susijungiantys atomai yra vienodo elektrinio neigiamumo arba jų elektrinis neigiamumas skiriasi ne daugiau kaip 0,4. Pavyzdžiui, alkanuose anglies ir vandenilio elektrinio neigiamumo skirtumas 0,3, todėl ryšys tarp šių atomų yra nepolinis.
Kovalentinių polinių ryšių susidarymas turi įtakos medžiagų savybėms. Jei molekulės turi krūvio polius, jos traukia viena kitą. Tai turi įtakos medžiagos lydymosi ir virimo temperatūrai, tirpumui, cheminėms reakcijoms. Išsamiau tai aptarsime nagrinėdami tarpmolekulinius ryšius.
Klausimai ir užduotys
- Paaiškinkite, kas atsitinka su elektronais susidarant:
- joniniam ryšiui;
- kovalentiniam ryšiui.
- Paaiškinkite, ką rodo elemento elektrinis neigiamumas ir kokias išvadas apie kovalentinį ryšį galima padaryti, atsižvelgiant į susijungiančių atomų elektrinio neigiamumo skirtumą.
- Išvardykite kovalentinio polinio ir kovalentinio nepolinio ryšio panašumus ir skirtumus.
- Nurodykite, kokių cheminių ryšių (kovalentinių nepolinių, kovalentinių polinių ar joninių) yra šiose medžiagose: Br2; CBr4; CaBr2; CaS; SO2; S8; NaBr; O2.
- Luiso formulėmis parodykite ryšių susidarymą, sąveikaujant pateiktiems atomams. Nurodykite, ar kiekvienas atomas įgyja elektronų oktetą (apskritimu pažymėkite oktetui priskiriamus elektronus). Nustatykite, koks yra susidaręs ryšys – polinis ar nepolinis.
- S ir Br atomai (susidaro SBr2);
- C ir F atomai (susidaro CF4);
- N ir H atomai (susidaro NH3);
- O ir H atomai (susidaro H2O);
- H ir H atomai (susidaro H2);
- O ir O atomai (susidaro O2).

