Dispersinės jėgos, hidrofilinis, hidrofòbinis, peptidinis ryšỹs, pirminė ir antrinė báltymo struktūrà.
Tarpmolekuliniai ryšiai
Visus iki šiol nagrinėtus cheminius ryšius galime pavadinti vienu žodžiu – tarpatominiai. Šiais ryšiais atomai sujungiami į joninį kristalą, molekulę, trimatį kovalentinį tinklą arba metalo kristalą. Silpnesni už tarpatominius yra tarpmolekuliniai ryšiai. Tai trauka tarp molekulių. Iš kur žinome, kad molekulės viena kitą traukia? Jei to nebūtų, molekulinės sandaros medžiagos bet kokioje temperatūroje būtų dujos. Bet taip nėra. Pati žemiausia lydymosi ir virimo temperatūra yra helio He ir vandenilio H2. Tarp šių molekulių tarpmolekuliniai ryšiai patys silpniausi.
Lydymosi ir virimo temperatūra, °C:
He | –272 ir –269 |
H2 | –259 ir –253 |
Ne | –249 ir –246 |
C6H6 | +6 ir +80 |
Kodėl didėjant molinei masei didėja virimo temperatūra?
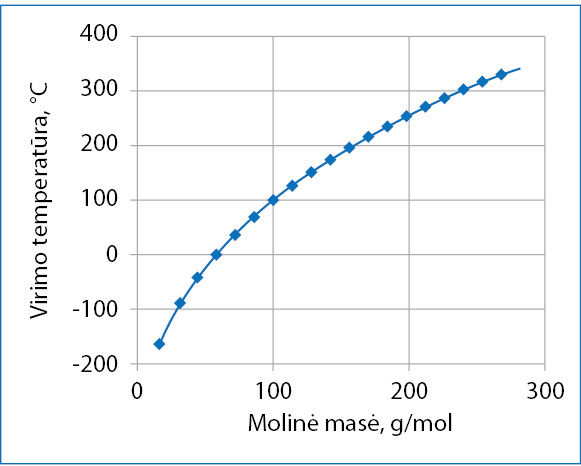
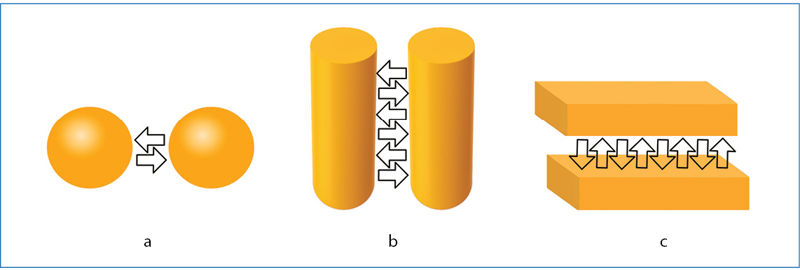
Alkanų molekulės yra panašios sandaros ir neturi polinių ryšių. Didėjant alkano molinei masei, didėja ir jo virimo temperatūra (3.7.1 pav.). Kodėl? Kuo didesnė molinė masė, tuo daugiau protonų ir elektronų yra molekulėje. Priežastis yra šių dalelių skaičius, o ne pati masė. Vienos molekulės protonai traukia kitos molekulės elektronus ir atvirkščiai. Tokia molekulių sąveika vadinama dispersinėmis jėgomis. Visos molekulės turi protonų ir elektronų, tad šio tipo sąveika pasireiškia tiek tarp polinių, tiek tarp nepolinių molekulių. Tai pati silpniausia iš tarpmolekulinių sąveikų. Ji pasireiškia tik labai mažu atstumu, tik ten, kur molekulės liečiasi, todėl priklauso ir nuo molekulės geometrinės formos. Pavyzdžiui, yra trys alkano C5H12 izomerai (3.7.2 pav.). Pakaitų neturinčio pentano molekulė yra ritinio formos. Tokios molekulės liečiasi šonais, visu molekulės ilgiu (3.7.3 pav.). Šio izomero virimo temperatūra aukščiausia. Žemiausia yra 2,2-dimetilpropano virimo temperatūra. Šio izomero molekulių forma artima rutuliui, o rutulių susilietimo plotas yra mažas. Todėl ir tarpmolekulinė trauka silpna. 2-metilbutanas turi vieną metilo pakaitą ir užima tarpinę padėtį pagal virimo temperatūrą.
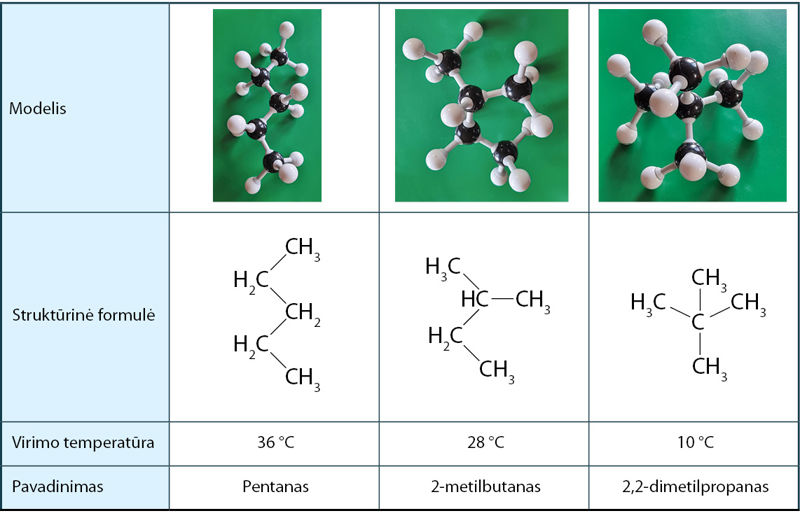
1 pavyzdys
2,2-dimetilbutanas ir 2-metilpentanas verda skirtingoje temperatūroje. Vienas iš šių junginių verda esant 60 °C, o kitas – 49 °C temperatūrai. Kurio junginio kokia virimo temperatūra? Paaiškinkite, kodėl.
Sprendimas
Abu junginiai yra vienodos molinės masės. Tai heksano izomerai. 2,2-dimetilbutanas yra labiau išsišakojusios erdvinės sandaros – turi du metilo pakaitus. Jo molekulių sąlyčio plotas mažesnis, tad jo virimo temperatūra 49 °C. Savo ruožtu 2-metilbutano molekulės turi tik po vieną pakaitą, jų forma artimesnė ritiniui. Jo virimo temperatūra 60 °C.
Polinių molekulių sąveika
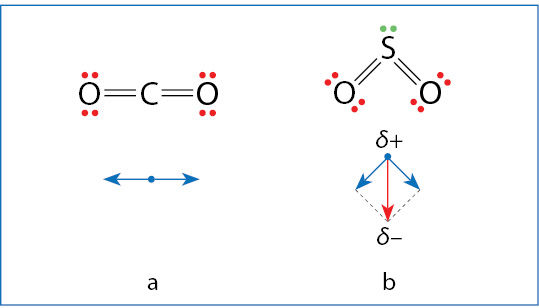
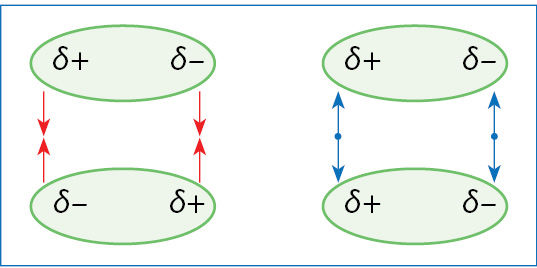
Polinių molekulių viename gale susikaupęs dalinis neigiamasis, o kitame – dalinis teigiamasis krūvis (žr. 3.2.3 pav.). Vienos molekulės teigiamasis polius traukia kitos molekulės neigiamąjį polių ir stumia teigiamąjį (3.7.4 pav.). Tokia sąveika gerokai stipresnė nei dispersinės jėgos. Ji priverčia molekules išsidėstyti tam tikra tvarka (3.7.5 pav.). Kad molekulė būtų polinė, nepakanka vien to, kad joje būtų kovalentinių polinių ryšių. Svarbus ir geometrinis ryšių išsidėstymas (3.7.6 pav.).
Vandenilinis ryšys
Tai pati stipriausia tapmolekulinė trauka. Jau iš pavadinimo aišku, kad susidarant šiam ryšiui dalyvauja vandenilis. Vandenilinis ryšys susidaro, jeigu vandenilio atomas yra sujungtas su didelio elektrinio neigiamumo ir mažo spindulio atomais – fluoru, deguonimi arba azotu. Dėl didelio elektrinio neigiamumo skirtumo vandenilis įgyja santykinai didelį dalinį teigiamąjį krūvį ir yra traukiamas prie dalinį neigiamąjį krūvį turinčio fluoro, deguonies arba azoto laisvosios elektronų poros (3.7.7 pav.).
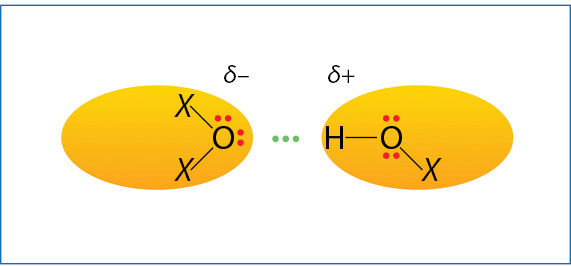
Kad vandenilis sudarytų vandenilinį ryšį, jis turi susijungti su fluoru, deguonimi arba azotu, o kitoje molekulėje turi būti fluorui, deguoniui arba azotui priklausanti laisvoji elektronų pora.
Kaip ir sąveikaujant polinėms molekulėms, dalinį teigiamąjį krūvį turintis vandenilio atomas traukia dalinį neigiamąjį krūvį turintį fluoro, deguonies arba azoto atomą. Tačiau jungiasi ne bet kur, o prie laisvosios elektronų poros. Ir jungiasi kryptingai, taip, kad trys atomai atsidurtų vienoje linijoje. Kryptingas ryšio sudarymas su laisvąja elektronų pora šiek tiek panašus į koordinacinio ryšio susidarymą.
Vandenilinio ryšio įtaka vandens savybėms
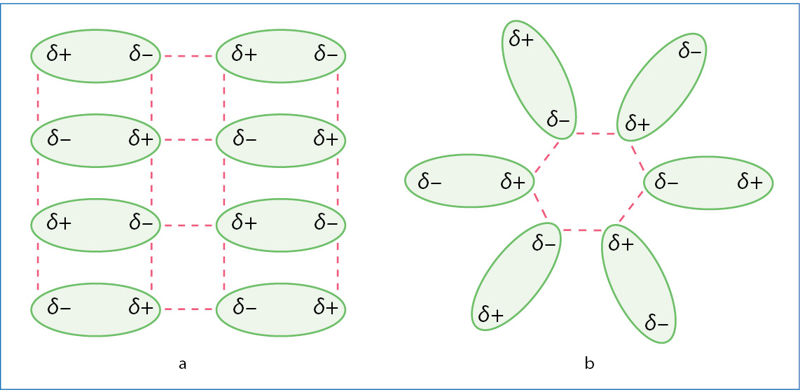
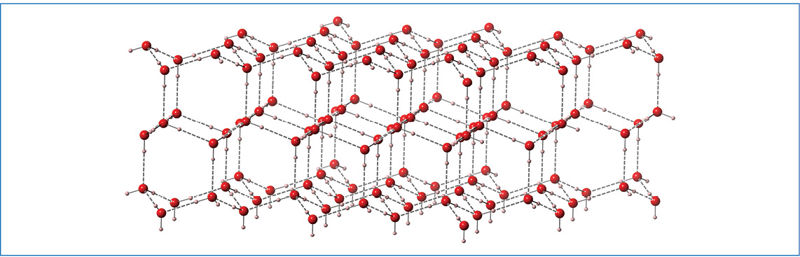
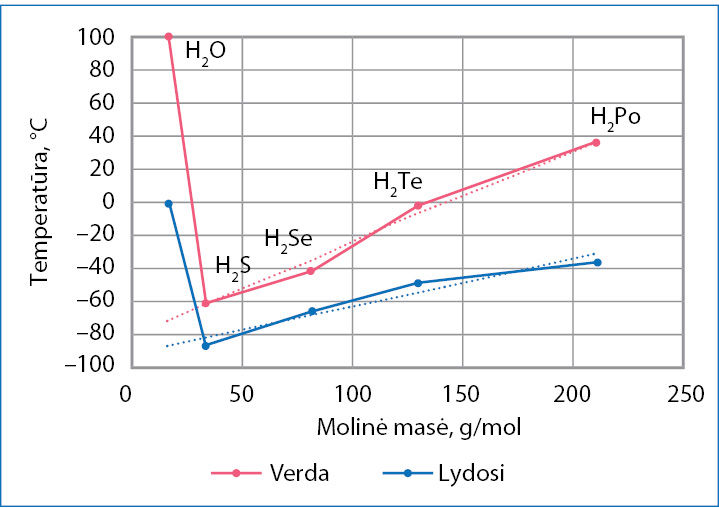
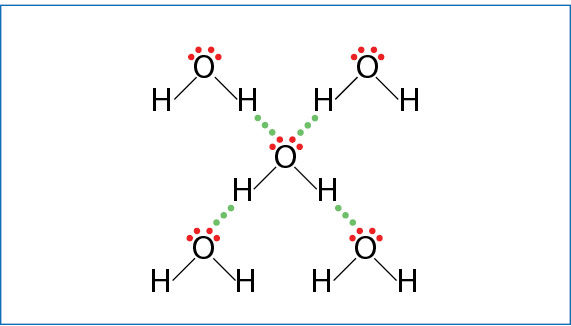
3.7.8 paveiksle matote 16 (VIA) grupės elementų junginių su vandeniliu H2O, H2S, H2Se, H2Te ir H2Po lydymosi (mėlyna kreivė) ir virimo (rausva kreivė) temperatūros priklausomybę nuo molinės masės. Mažėjant molinei masei (nuo H2Po iki H2S), lydymosi ir virimo temperatūra irgi mažėja. Tai susiję su dispersinių sąveikų silpnėjimu. Tik vandens lydymosi ir virimo temperatūra nedera su visai grupei būdingu dėsningumu. Punktyrinės linijos rodo, kokia galėtų būti vandens lydymosi ir virimo temperatūra, jei jam galiotų bendras visai grupei dėsningumas. Toks temperatūros didėjimas susijęs su vandeniliniais ryšiais tarp vandens molekulių (3.7.9 pav.). Vandens agregatinei būsenai pakeisti reikia papildomos energijos vandeniliniams ryšiams nutraukti. Ledo struktūroje visos vandens molekulės yra suformavusios po keturis vandenilinius ryšius (kaip 3.7.9 pav.) ir sudaro vientisą vandeniliniais ryšiais sujungtų molekulių trimatį tinklą (paveiksle parodyta dvimatė išklotinė). Skystame vandenyje yra didesnių ir mažesnių vandeniliniais ryšiais sujungtų vandens molekulių grupių. Tokią grupę gali sudaryti nuo kelių iki kelių šimtų susijungusių molekulių. Vienos grupės suyra, kitos susidaro. Kiek vidutiniškai vandens molekulių sudaro vieną grupę, dažniausiai priklauso nuo temperatūros. Kuo temperatūra žemesnė, tuo didesnės susijungusių vandens molekulių grupės. Lede visos molekulės susijungia (3.7.10 pav.), išsidėsto šešiakampiais žiedais. Taip vandenilinių ryšių išrikiuotos molekulės užima daugiau vietos. Todėl kietosios būsenos vandens (ledo) tankis mažesnis nei skysto vandens.
Vandenilinio ryšio įtaka organinių medžiagų tirpumui vandenyje
Sakoma: „Panašus tirpina panašų“. Nepolinės medžiagos tirpsta nepoliniuose tirpikliuose (pavyzdžiui, riebalai tirpsta benzene, bet netirpsta vandenyje), o polinės ir joninės – vandenyje arba kituose poliniuose tirpikliuose.
Metanas ir etanas vandenyje netirpsta, o štai metanolį ir etanolį su vandeniu galima maišyti bet kokiu santykiu – šios medžiagos yra begalinio tirpumo. Alkanų molekulės yra nepolinės ir nesudaro vandenilinių ryšių su vandeniu. Alkoholiai turi OH grupes ir gali sudaryti vandenilinius ryšius tiek tarpusavyje, tiek su vandens molekulėmis (3.7.11 pav.). Tai ir lemia jų tirpumą vandenyje.
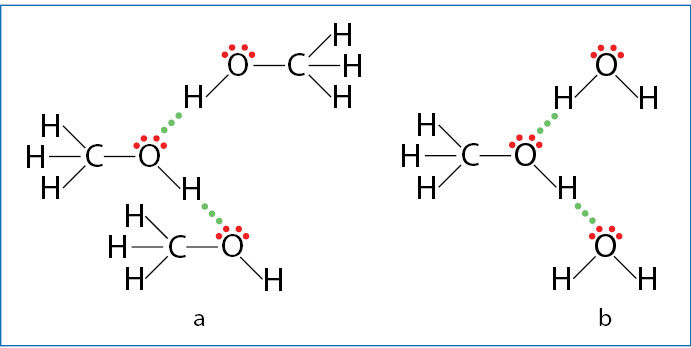
Alkoholio molekulėje galima išskirti dvi dalis – hidrofilinę (pažodžiui vandenį mylinčią, t. y. OH grupę, kuri vandeniliniais ryšiais jungiasi su vandeniu) ir hidrofòbinę (pažodžiui vandens bijančią, t. y. alkano radikalą). Hidrofilinė grupė suteikia tirpumo vandenyje, o hidrofobinė tirpumą mažina. Kuo anglies atomų grandinė ilgesnė, tuo labiau medžiagos savybes lemia hidrofobinė grupė, todėl ilgėjant šiai grandinei alkoholių tirpumas vandenyje mažėja.
Kitų klasių organinių junginių tirpumo vandenyje dėsningumai panašūs į alkoholių. Tirpumą didinančios hidrofilinės grupės yra: hidroksilo, karbonilo, karboksilo, eterio ir amino (3.3 lentelė).
3.3 lentelė. Vandenilinius ryšius sudarantys organiniai junginiai
Junginiai | Ar sudaro vandenilinius ryšius tarpusavyje? Kokią įtaką tai daro savybėms? | Ar sudaro vandenilinius ryšius su vandens molekulėmis? Kokią įtaka tai daro tirpumui? |
Alkoholiai | Taip. Aukštesnė virimo temperatūra (palyginti su panašios molinės masės alkanais). | Taip. Mažos molinės masės – tirpūs vandenyje. |
Eteriai | Ne. Žemesnė virimo temperatūra (palyginti su alkoholiais), bet aukštesnė nei alkanų. | Taip. Tik keletas mažos molinės masės – tirpūs vandenyje. |
Pirminiai ir antriniai aminai | Taip. Aukštesnė virimo temperatūra (palyginti su panašios molinės masės alkanais). | Taip. Mažos molinės masės – tirpūs vandenyje. |
Tretiniai aminai | Ne | Taip. Mažos molinės masės – tirpūs vandenyje. |
Aldehidai ir ketonai | Ne. Virimo temperatūra žemesnė už alkoholių, bet aukštesnė nei alkanų. | Taip. Mažos molinės masės – tirpūs vandenyje. |
Karboksirūgštys | Taip. Virimo temperatūra aukštesnė už alkoholių. | Taip. Mažos molinės masės – tirpūs vandenyje. |
Aminorūgštys | Taip. Kambario temperatūroje kietosios medžiagos. | Taip. Tirpios vandenyje. |
Esteriai | Ne. Žemesnė virimo temperatūra (palyginti su alkoholiais). | Taip. Tik keletas mažos molinės masės – tirpūs vandenyje (pvz., metilmetanoatas). |
2 pavyzdys
Propanono (acetono) molekulės tarpusavyje nesudaro vandenilinių ryšių, bet sudaro ryšius su vandens molekulėmis. Paaiškinkite, kodėl. Kokių savybių tai suteikia propanonui?
Sprendimas
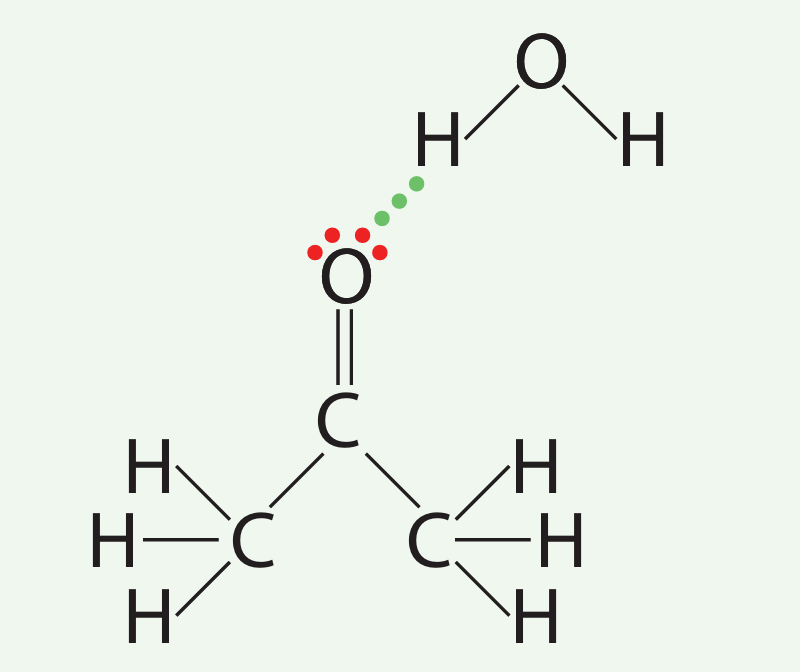
Vandenilinis ryšys gali susidaryti tik jei vandenilis sujungtas su fluoro, deguonies arba azoto atomu. Propanono molekulėje vandenilio atomai sujungti su anglies atomu. Propanonas neturi vandeniliniam ryšiui sudaryti tinkamo vandenilio atomo. Tačiau propanono molekulėje yra dvi laisvąsias elektronų poras turintis deguonies atomas. Prie šių laisvųjų porų jungiasi vandens molekulės vandenilio atomas (3.7.12 pav.).
Dėl gebėjimo sudaryti vandenilinius ryšius su vandens molekulėmis propanonas yra begalinio tirpumo. Propanono molekulės negali sudaryti vandenilinių ryšių tarpusavyje, todėl propanonas yra greitai garuojantis (lakus) skystis. Jo virimo temperatūra gana žema, tik 56 °C.
Vandenilinis ryšys baltymuose ir DNR
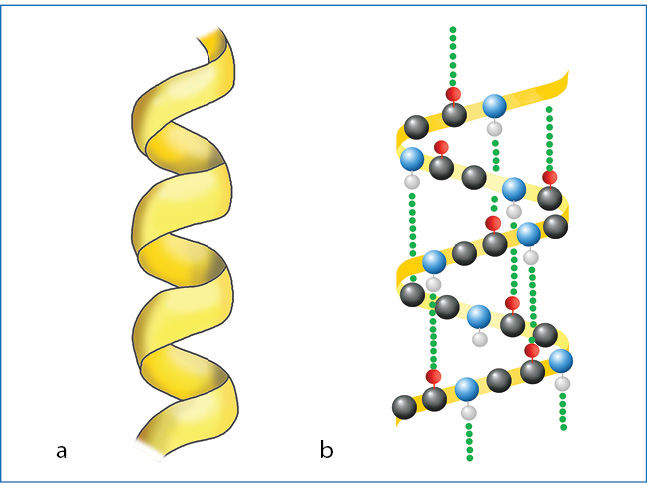
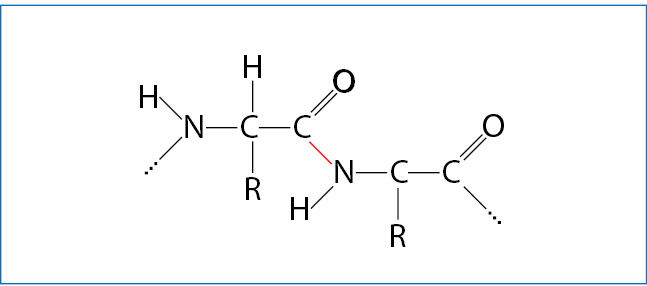
Baltymai susidaro susijungus aminorūgščių molekulėms. Tarp dviejų baltymų aminorūgščių fragmentų esantis kovalentinis ryšys vadinamas peptidiniu ryšiù (3.7.13 pav.). Aminorūgščių sujungimo seka vadinama pirminè báltymo struktūrà. Susijungusių aminorūgščių grandinė (polipeptidinė grandinė) gali įgyti spiralės formą (3.7.14 pav., a). Tai antrinė báltymo struktūrà. Ją lemia tam tikrais atstumais tarp vienos vijos N–H grupės ir kitos vijos C=O grupės susidarę vandeniliniai ryšiai (3.7.14 pav., b).
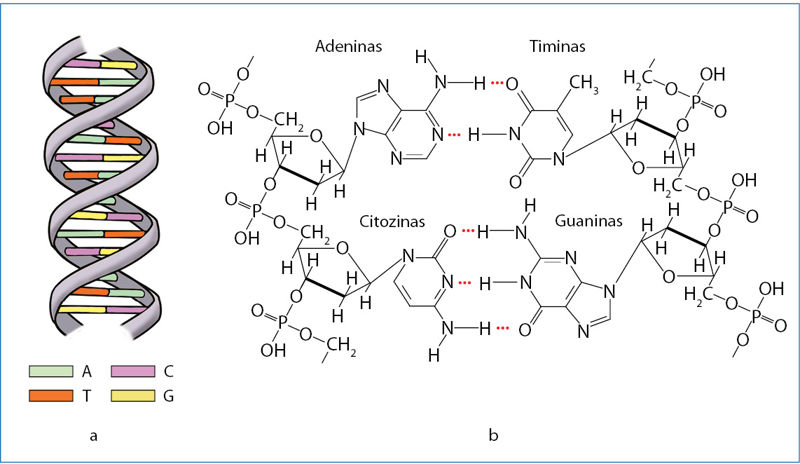
Jums neabejotinai teko regėti raidžių derinius DNR ir RNR. Tai nukleorūgščių deoksiribonukleorūgštis ir ribonukleorūgštis pavadinimų trumpiniai. Medžiagos, kurias vadiname nukleorūgštimis, skirtos organizmų genetinei informacijai saugoti ir perduoti. Polimerinėje DNR molekulėje užkoduota informacija apie kiekvieną organizmo baltymą. Polimerinių medžiagų molekulėse išskiriamos besikartojančios grandys. DNR molekulėse tokios grandys vadinamos nukleotidais. Kiekvienas nukleotidas susidaro susijungus fosforo rūgščiai, sacharidui (deoksiribozei) ir organinei azoto bazei. DNR molekulėse aptinkamos keturios bazės: adeninas (žymimas A), timinas (T), guaninas (G) ir citozinas (C). Nukleotidai skiriasi tik šiomis bazėmis. Informacija apie baltymų sandarą „užrašoma“ tam tikra tvarka sujungiant nukleotidus. Ląstelėms dalijantis DNR molekulėse užkoduota informacija turi išlikti nepakitusi. DNR molekulės yra dvigubos – jos sudarytos iš dviejų vandeniliniais ryšiais sujungtų vijų. Vandenilinius ryšius gali sudaryti tik tam tikros azoto bazių poros. Atomų geometrinis išsidėstymas yra toks, kad jungtis gali tik adeninas su timinu (susidaro du ryšiai) ir guaninas su citozinu (susidaro trys ryšiai). Ląstelėms dalijantis DNR molekulės vijos atsiskiria. Kiekvienai viengubai vijai sukuriama nauja antroji vija, kurioje nukleotidai sujungti tokia pačia seka, kaip ir pradinėje DNR molekulėje. Tai įmanoma todėl, kad vandenilinius ryšius gali sudaryti tik jau minėtos bazių poros – adeninas su timinu, guaninas su citozinu (3.7.15 pav.).
Klausimai ir užduotys
- Nurodykite tris vandens fizikines savybes, kurios būtų kitokios, jeigu šios medžiagos molekulės negalėtų sudaryti vandenilinių ryšių.
- Etanalio molekulės tarpusavyje nesudaro vandenilinių ryšių, tačiau sudaro juos su vandens molekulėmis. Paaiškinkite, kodėl.
- Vasarą ežero paviršiumi vaikščioti negalime. O žiemą, jei susidaro ne mažiau kaip 10 cm ledo sluoksnis, ledu eiti galime. Remdamiesi žiniomis apie molekulių sąveikas paaiškinkite, kodėl neprasmengame gilyn atsistoję ant storo ledo paviršiaus.
- Lentelėje pateikta vandenilio halogenidų virimo temperatūra. Sudarykite virimo temperatūros stulpelinę diagramą, junginius išrikiuodami molinės masės didėjimo seka. Kokį pastebite dėsningumą ir kokį nukrypimą nuo šio dėsningumo? Paaiškinkite, kodėl keičiantis molinei masei virimo temperatūra kinta būtent taip.
Junginio formulė | HF | HCl | HBr | HI |
Virimo temperatūra, °C | +19 | –85 | –67 | –35 |
- Raskite 15 (VA) grupės elementų junginių su vandeniliu lydymosi temperatūras. Sudarykite lydymosi temperatūros stulpelinę diagramą, junginius išrikiuodami molinės masės didėjimo seka. Kokį pastebite dėsningumą ir kokį nukrypimą nuo šio dėsningumo? Paaiškinkite, kodėl keičiantis molinei masei lydymosi temperatūra kinta būtent taip.
- Struktūrinėmis formulėmis parodykite vandenilinio ryšio susidarymą tarp vienos dimetileterio CH3–O–CH3 ir vienos vandens molekulės.