Periodinės lentelės ir planetinio atomo modelio vaizdinys asocijuojasi su mokslu. Šiuos simbolius atpažįsta visi. Pirmąsias periodines lenteles nepriklausomai vienas nuo kito sudarė Dmitrijus Mendelejevas (Дмитрий Менделеев, 1834–1907) ir Julius Lotaras Mejeris (Julius Lothar Meyer, 1830–1895). Paprastai moksliniai atradimai neatsiranda staiga ir tik vieno žmogaus pastangomis. Bandymų klasifikuoti elementus buvo ir prieš D. Mendelejevą ir J. L. Mejerį. XIX a. pirmosios pusės chemijos vadovėliuose jau buvo aptariamos tokios panašių savybių elementų grupės kaip halogenai, šarminiai metalai. Periodinės lentelės sudarymas labiau siejamas su D. Mendelejevu. Šis mokslininkas ne tik klasifikavo tuo metu žinomus elementus į vieną sistemą, bet remdamasis panašumais numatė dar neatrastų elementų savybes ir vietą periodinėje lentelėje. Pirmosios lentelės sudarytos remiantis vieninių ir sudėtinių medžiagų fizikinių ir cheminių savybių panašumais bei periodiniu pasikartojamumu. Tik išsiaiškinus atomo sandarą, paaiškėjo periodiškumo priežastis. Panašūs yra tie elementai, kurių išorinio elektronų sluoksnio konfigūracija sutampa. Elektronų sluoksnių talpa yra baigtinė. Užpildžius vieną sluoksnį, seka naujas elektronų sluoksnis ir naujas periodas.
Išnagrinėję šį skyrių, gebėsite:
- paaiškinti periodinės lentelės sandarą;
- suformuluoti periodinį dėsnį;
- susieti atomų spindulio periodinį kitimą su metališkųjų ir nemetališkųjų savybių bei elektrinio neigiamumo kitimu;
- numatyti elemento būdinguosius oksidacijos laipsnius ir junginius, kuriuose tie oksidacijos laipsniai pasireiškia;
- palyginti oksidų savybes pagal juos sudarančių elementų padėtį periodinėje lentelėje;
- palyginti elementų junginių su vandeniliu savybes pagal tų elementų padėtį periodinėje lentelėje;
- apskaičiuoti elemento oksidacijos laipsnį junginiuose ir jonuose.
Elementų elektroninės sandaros ir savybių periodiškumas
Atòminis skaičius, periòdas, grùpė, pagrindinės grùpės, péreinamieji elemeñtai, šarminiai metãlai, šarminių žẽmių metãlai, halogènai, inèrtinės dùjos, lantanòidai, aktinòidai, atòmo spindulỹs, elektrinis neigiamùmas.
Periodinė lentelė
Trumpai pakartokime periodinės elementų lentelės sandarą.
- Elementai periodinėje lentelėje surašyti atominio skaičiaus Z didėjimo tvarka. Atominis skaičius Z rodo branduolio krūvį. Jis sutampa su protonų skaičiumi, o neutraliųjų atomų – ir su elektronų skaičiumi.
- Gulsčiosios eilės vadinamos periòdais. Periodo numeris rodo, keliais sluoksniais yra išsidėstę elektronai.
- Stulpeliai vadinami grùpėmis. Grupės numeruojamos nuo 1 iki 18. Vis dar vartojama ir senesnė grupių numeracija, pavyzdžiui, IIIA, IIIB.
- 1, 2 ir 13–18 grupės vadinamos pagrindinėmis.
- Pagrindinių grupių elementai išoriniame sluoksnyje turi tiek elektronų, koks yra grupės numerio paskutinis skaitmuo (pavyzdžiui, 13 grupės elementai – tris). Šie elektronai vadinami valentiniais.
- Toje pačioje grupėje esantys elementai turi panašių savybių.
- 3–12 grupių elementai vadinami pereinamaisiais, arba šalutinių grupių elementais. Jų valentiniai elektronai yra dviejuose sluoksniuose: išorinio sluoksnio s ir priešpaskutinio sluoksnio d orbitalėse.
- Elementai skirstomi į metalus, nemetalus ir pusmetalius. Skiriamoji riba tarp metalų ir nemetalų periodinėje lentelėje pažymėta kitos spalvos laužte. Pusmetaliai turi ir metalams, ir nemetalams būdingų savybių. Lentelėje jie yra greta skiriamosios ribos, tarp metalų ir nemetalų. Iš pirmųjų keturių periodų pusmetaliams priskiriami boras, silicis, germanis ir arsenas.
- 1-osios grupės elementai (išskyrus vandenilį) vadinami šarminiais metãlais.
- 2-osios grupės elementai (išskyrus berilį) vadinami šarminių žemių metãlais.
- 17-osios grupės elementai vadinami halogènais.
- 18-osios grupės elementai vadinami inertinėmis dùjomis.
- 6-ajame periode tarp lantano ir hafnio yra įsiterpę 14 elementų, vadinamų lantanòidais.
- 7-ajame periode tarp aktinio ir rezerfordžio yra įsiterpę 14 elementų, vadinamų aktinòidais.
- Lantanoidai ir aktinoidai iškelti iš periodinės lentelės ir surašyti papildomose eilutėse.
Periodinis dėsnis
Jis formuluojamas taip:
Nuosekliai didėjant branduolio krūviui, elementų ir iš jų sudarytų vieninių bei sudėtinių medžiagų savybės kinta periodiškai.
Aiškindamiesi atomo sandarą jau pastebėjome, kad, nuosekliai didėjant protonų skaičiui branduolyje, elektronų skaičius išoriniame sluoksnyje kinta periodiškai – didėja iki aštuonių (pirmajame periode iki dviejų), tada atsiranda naujas sluoksnis, ir elektronų skaičius jame pradeda iš naujo kisti nuo vieno iki aštuonių. Elektroninės sandaros periodiškumas lemia elementų savybių periodinį pasikartojimą.
Vieno periodo atomų spindulys
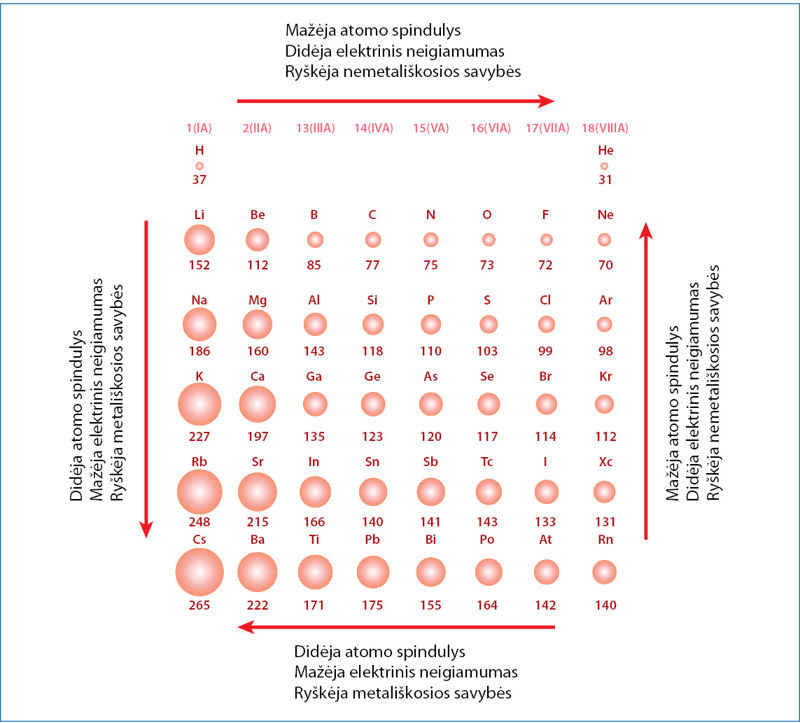
Iš pirmo žvilgsnio gali pasirodyti, kad atòmo spindulys yra tik mechaninė ypatybė, mažai susijusi su cheminėmis savybėmis. Tai netiesa. Pamatysime, kad jis susijęs su elementų savybių kitimu. Aptarkime antrojo periodo elementų atomus (4.1.1 pav.). Didžiausias jų yra ličio (nors ir turi mažiausiai protonų, neutronų ir elektronų), o mažiausias – neono atomas (sudarytas iš gerokai didesnio protonų, neutronų ir elektronų skaičiaus). Atomo branduolys yra nepaprastai didelio tankio ir užima nykstamai mažą atomo tūrio dalį – tik apie vieną kvadriljonąją1. Iš esmės atomas yra tuščia erdvė. Tad atomo spindulys priklauso ne nuo atomą sudarančių dalelių skaičiaus, o nuo traukos ir stūmos jėgų tarp elektros krūvį turinčių dalelių.
1 Kvadriljonas yra 1 · 1015.
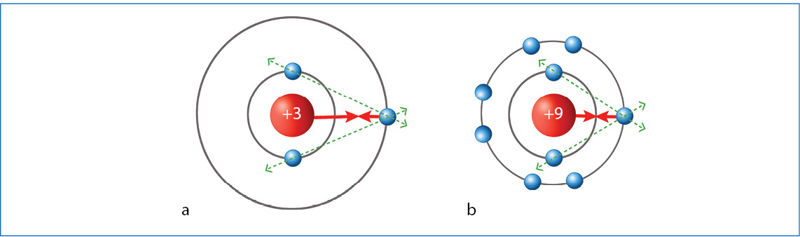
Įdėmiai išnagrinėkite 4.1.2 paveikslą. Nors paveikslo apraše pateiktas labai supaprastintas valentinį elektroną veikiančių krūvių skaičiavimas, jis atskleidžia svarbiausią priežastį, kodėl periode, didėjant atominiam skaičiui (gausėjant protonų), atomas mažėja.
Nagrinėdami cheminius ryšius išsiaiškinome, kad:
- atomo gebėjimą traukti elektronus rodo elektrinis neigiamumas;
- reaguojant metalui su nemetalu, metalas valentinius elektronus praranda, o nemetalas prisijungia.
Ličio valentinis elektronas yra traukiamas suminio krūvio +1, o fluoro +7. Todėl:
- ličio valentinis elektronas yra toli nuo branduolio (atomas santykinai didelis);
- fluoro valentiniai elektronai pritraukiami gerokai arčiau branduolio (atomas mažesnis už ličio);
- silpnai traukiamą elektroną iš ličio lengva atimti (lengvai virsta teigiamuoju jonu);
- fluoras elektroną prisijungia (tampa neigiamuoju jonu);
- ličio elektrinis neigiamumas mažas (1,0);
- fluoro elektrinis neigiamumas didelis (4,0).
Neonas išoriniame sluoksnyje turi 8 elektronus. Daugiau į šį sluoksnį elektronų nebetelpa. Todėl kito elemento – natrio – valentinis elektronas atsiduria trečiojo sluoksnio 3s orbitalėje. Natrio branduolio krūvis +11, bet tarp valentinio elektrono ir branduolio yra įsiterpę 10 elektronų (2 pirmajame sluoksnyje ir 8 antrajame). Tad natrio valentinį elektroną veikiantis suminis krūvis yra tik +11 + 10 · (–1) = +1. Sumažėjęs suminis krūvis lemia, kad natrio spindulys, palyginti su ankstesnio elemento neono, šuoliškai padidėja. Mažas suminis krūvis lemia silpną traukos jėgą, tad valentinis elektronas gerokai nutolsta nuo branduolio. Tokį elektroną lengva atimti, o tai būdinga šarminiams metalams. Taip po neono atsiranda naujas šarminis metalas natris. Tada istorija kartojasi. Didėjant branduolio krūviui, trečiojo periodo atomų spindulys mažėja, elektrinis neigiamumas didėja ir, galiausiai, periodas baigiasi halogenu (chloru) ir inertinėmis dujomis (argonu).
Sluoksniuose telpa baigtinis elektronų skaičius, todėl, branduolio krūviui nuosekliai didėjant, atomo spindulys, elektrinis neigiamumas ir metališkosios bei nemetališkosios savybės periodiškai pasikartoja. Periodai (išskyrus pirmąjį) prasideda šarminiu metalu, o baigiasi halogenu ir inertinių dujų atomu. Einant periodu nuo šarminio metalo iki halogeno, metališkosios savybės palaipsniui silpnėja, o nemetališkosios stiprėja.
Vienos grupės atomų spindulys
Vienos grupės elementai turi vienodą valentinių elektronų, bet skirtingą elektronų sluoksnių skaičių. Gausėjant elektronų sluoksnių, atomo spindulys didėja (4.1.1 pav.). Valentinis elektronas negali priartėti arčiau dėl giluminių elektronų sluoksnių. Didėjant atstumui tarp branduolio ir valentinio elektrono, traukos jėga silpsta. Vadinasi, iš didesnio atomo elektronus atimti lengviau. Didėjant atomo spinduliui, mažėja elektrinis neigiamumas, o metališkosios savybės tampa vis labiau išreikštos.
Metališkosios ir nemetališkosios savybės
Metališkosios ir nemetališkosios savybės apima visą kompleksą elementų požymių (4.1 lentelė). Įvairių savybių kitimo dėsningumai pagrindinėse grupėse apibendrinti 4.1.1 paveiksle.
4.1 lentelė. Būdingosios pagrindinių grupių metalų ir nemetalų savybės
Metalų atomai | Nemetalų atomai | |
Išorinio sluoksnio elektronus veikianti branduolio trauka | Silpna | Stipri |
Atomo spindulys | Didelis | Mažas |
Elektrinis neigiamumas | Mažas | Didelis |
Elektroninės sandaros pokyčiai reaguojant | Netenka valentinių elektronų ir virsta teigiamaisiais jonais. |
|
Sudaro ryšius | Joninius ir metališkuosius | Joninius ir kovalentinius |
Oksidų savybės | Dažniausiai sudaro bazinius oksidus, kartais – amfoterinius. | Dažniausiai sudaro rūgštinius oksidus, kartais – neutraliuosius. |
Junginių su vandeniliu savybės | Bazinės | 17 ir 16 grupės (išskyrus deguonį) – rūgštinės; |
Klausimai ir užduotys
- Sudarykite stulpelinę diagramą, kurioje būtų parodytas antrojo ir trečiojo periodo elementų spindulio (vienos spalvos stulpeliais) ir elektrinio neigiamumo (kitos spalvos stulpeliais) kitimas, kai elementai išrikiuojami atominio skaičiaus didėjimo tvarka.
- Naudodamiesi tik periodine lentele nurodykite, kurio elemento atomas didesnis (atsakymus pasitikrinkite 4.1.1. paveiksle):
- sieros ar chloro;
- sieros ar seleno;
- rubidžio ar stroncio;
- stroncio ar kalcio.
- Nesinaudodami periodine lentele nustatykite, kurioje periodinės lentelės grupėje yra elementas, kurio branduolio krūvis +15.
- X ir Y yra du nežinomi to paties periodo elementai. Pirmojo elemento branduolio krūvis yra z, o antrojo z + 3.
- Kurio elemento atomas yra didesnis?
- Kurio elemento elektrinis neigiamumas didesnis?
- Iš kurio elemento atomų lengviausia atimti valentinius elektronus: natrio, magnio, kalio ar kalcio?

