Stiprùsis elektrolitas, silpnàsis elektrolitas, neelektrolitas, jonizãcija, bedeguõnė rūgštis, deguõninė rūgštis, bendróji lygtis, nesutrumpintoji jòninė lygtis, sutrumpintoji jòninė lygtis, indikãtorius.
Elektrolitai ir neelektrolitai
Mainų reakcijose dalyvauja joninės medžiagos ir tos kovalentinės medžiagos, kurios gali jonizuotis – suskilti į jonus. Visos šios medžiagos vadinamos elektrolitais ir skirstomos į stipriúosius ir silpnúosius elektrolitùs (4.7 lentelė). Jonų nesudarančios medžiagos vadinamos neelektrolitais.
4.7 lentelė. Stiprieji ir silpnieji elektrolitai
Medžiagų kategorija | Paaiškinimai |
Stiprieji elektrolitai | Tirpale visa medžiaga yra jonų pavidalo. Tai:
|
Silpnieji elektrolitai | Tik nedidelė medžiagos dalis tirpale yra jonų pavidalo, dauguma jos lieka molekulių pavidalo. Tai:
|
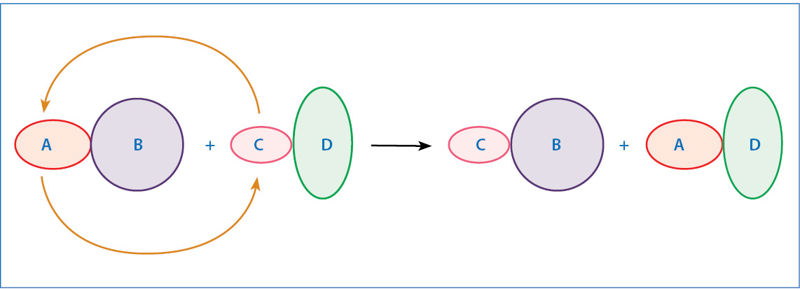
Vykstant mainų reakcijai, formuliniai vienetai apsikeičia savo sudėtinėmis dalimis (4.7.2 pav.). Dažniausiai pasitaikančios mainų reakcijos yra:
- Neutralizacijos:
2HNO3(aq) + Ba(OH)2(aq) → Ba(NO3)2(aq) + 2H2O(s).
(4.7.1)
- Nuosėdų susidarymo:
Ba(NO3)2(aq) + Na2CO3(aq) → 2NaNO3(aq) + BaCO3(k).
(4.7.2)
- Dujų išsiskyrimo:
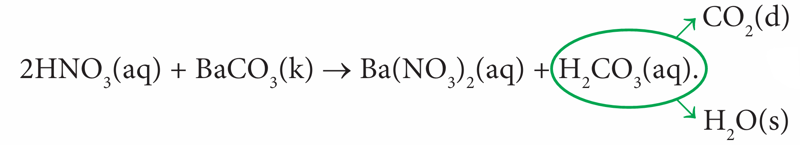
(4.7.3)
Bendrosios ir joninės lygtys
Pirmiau parašytos (4.7.1)–(4.7.3) lygtys vadinamos bendrósiomis. Tačiau tirpale nėra HNO3 arba Ba(NO3)2 molekulių. Stiprieji elektrolitai tirpale būna tik jonų pavidalo. Kokių dalelių yra tirpale, tiksliau rodo nesutrumpintoji jòninė lygtis. Bendrąją (4.7.1) lygtį parašysime kaip nesutrumpintąją:
2H+(aq) + (aq) + Ba2+(aq) + 2OH–(aq) → Ba2+(aq) +
(4.7.4)
Ne visi jonai reaguoja. Nitrato ir bario jonai lieka kokie buvę. Reaguoja tik mėlynai pažymėti jonai. Kas ir kaip pakinta medžiagoms reaguojant, geriausiai parodo sutrumpintoji jòninė lygtis. Ji gaunama išbraukus nereaguojančius jonus:
2H+(aq) + 2OH–(aq) → 2H2O(s).
(4.7.5)
Suprastinkime bendrą daliklį turinčius koeficientus:
H+(aq) + OH–(aq) → H2O(s).
(4.7.6)
Taigi sudarydami jonines lygtis:
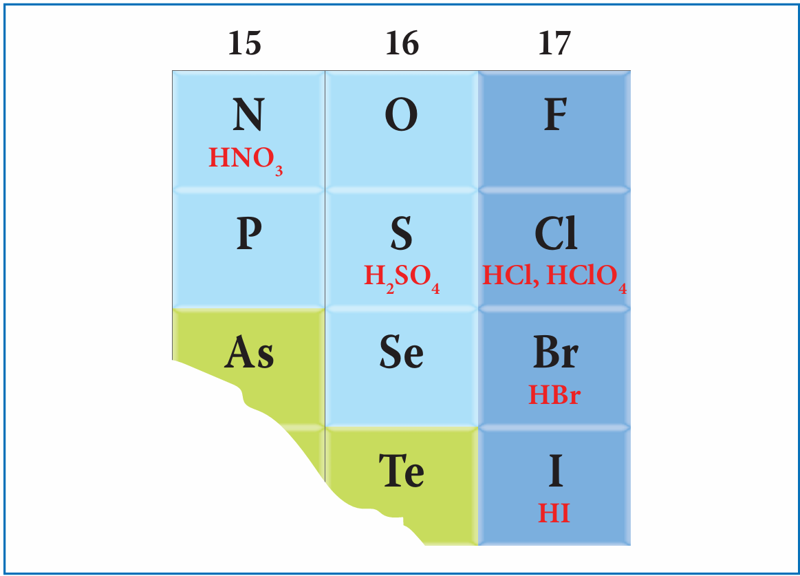
- stipriuosius elektrolitus (stipriąsias rūgštis, tirpiąsias druskas ir tirpiuosius hidroksidus) rašome suskilusius į jonus, nes tirpale jų būna tik jonų pavidalo;
- silpnuosius ir netirpiuosius elektrolitus, taip pat neelektrolitus paliekame nesuskaidytus į jonus, nes vienų tik nedidelė dalis skyla į jonus, o kitų apskritai neskyla.
Neutralizacijos reakcijos
Rūgštinės ir bazinės savybės yra priešingos. Šių priešingų savybių turinčios medžiagos neutralizuoja1 („naikina“) viena kitą, sudarydamos druską. Dauguma neutralizacijos reakcijų yra mainų reakcijos, pavyzdžiui, reakcija (4.7.1). Yra ir kitokių neutralizacijos reakcijų.
1 Lot. neutrō – nei į vieną, nei į kitą pusę.
- Amoniako neutralizaciją galime priskirti prie jungimosi reakcijų (iš dviejų medžiagų susidaro viena):
2NH3(d) + H2SO4(aq) → (NH4)2SO4(aq);
(4.7.7a)
arba sutrumpintąja jonine lygtimi:
NH3(d) + H+(aq) → NH4+(aq).
(4.7.7b)
- Bazinio ir rūgštinio oksido reakcija yra ir neutralizacijos, ir jungimosi:
CaO(k) + CO2(d) → CaCO3(k).
(4.7.8)
Atkreipkite dėmesį, kad susidaro tokia pati druska, kuri susidarytų, jei reaguotų iš bazinio oksido CaO gaunamas hidroksidas Ca(OH)2 ir iš rūgštinio oksido CO2 gaunama rūgštis H2CO3. Reaguojant hidroksidui ir rūgščiai, būtų dar vienas produktas – vanduo.
- Druska ir rūgštis reaguoja, jei yra galimybė susidaryti silpnajai rūgščiai, pavyzdžiui:
Ca(CH3COO)2(aq) + 2HCl(aq) → 2CH3COOH(aq) + CaCl2(aq);
(4.7.9a)
arba sutrumpintąja jonine lygtimi:
CH3COO–(aq) + H+(aq) → CH3COOH(aq).
(4.7.9b)
Šią reakciją galime pavadinti „daline neutralizacija“, nes vietoj stipriosios druskos rūgšties HCl susidarė silpnoji etano (acto) CH3COOH rūgštis. Tirpalas pasidaro mažiau rūgštus, nes tik apie 1–3 % etano rūgšties molekulių jonizuojasi, todėl tirpale vandenilio jonų koncentracija sumažėja. Rūgščių ir bazių tirpalams atpažinti naudojami indikãtoriai – priklausomai nuo tirpalo terpės spalvą keičiančios medžiagos (4.8 lentelė).
4.8 lentelė. Indikatorių spalvos
Indikatorius | Spalva | ||
Rūgštiniame tirpale | Neutraliajame tirpale | Baziniame tirpale | |
Metiloranžinis | Rožinis (rausvas) | Oranžinis | Geltonas |
Fenolftaleinas | Bespalvis | Bespalvis | Avietinis (rausvas) |
Lakmusas | Raudonas | Violetinis | Mėlynas |
Klausimai ir užduotys
- Parašykite bazinio oksido ir druskos rūgšties tirpalo bendrąją ir sutrumpintąją joninę reakcijos lygtį.
- Parašykite rūgštinio oksido ir kalio hidroksido tirpalo bendrąją ir sutrumpintąją joninę reakcijos lygtį.
- Kokiomis savybėmis pasižymi 15 grupės nemetalų junginiai su vandeniliu? Su kuo jie reaguoja – su druskos rūgšties ar kalio hidroksido tirpalu? Parašykite pasirinktos medžiagų poros bendrąją ir sutrumpintąją joninę reakcijos lygtį.
- Ar reaguoja su rūgštimis arba bazėmis:
- 14 grupės nemetalų junginiai su vandeniliu;
- 14 grupės nemetalų oksidai?
Jeigu reakcija vyksta, parašykite bendrąsias ir sutrumpintąsias jonines reakcijų lygtis.
