Norėdami suprasti cheminių junginių savybes ir jų kitimus, turime žinoti, kaip cheminiai elementai sudaro įvairius junginius. Elementų atomai jungiasi tarpusavyje cheminiais ryšiais. Vieni ryšiai yra labai tvirti, kiti – silpni. Visi jie lemia skirtingas junginių savybes. Šiame skyriuje sužinosite, kaip atsiranda cheminiai ryšiai, kaip jie suyra, kaip susidaro krūviai atsiradus cheminiams ryšiams, – taigi perprasite ir svarbiausius chemijos dėsnius.
Atomų stabilumas
Nagrinėdami periodinę cheminių elementų lentelę atkreipėme dėmesį, kad cheminiai elementai pagal savo prigimtį yra labai skirtingi.
Patys stabiliausi yra tie, kurių atomų išorinis elektronų sluoksnis yra užpildytas (3.1.1 pav.). Šių elementų atomai yra neaktyvūs, jie nesudaro jokių junginių. Jau žinote, kad tokia savybė būdinga inertinėms dujoms, kurios yra VIIIA grupėje. Visos šios grupės dujos išoriniame sluoksnyje turi po 8 elektronus, tik helis – 2.
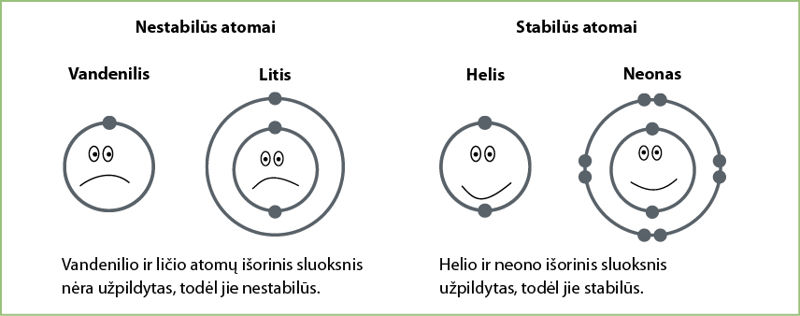
Kitų elementų atomai yra aktyvesni – jie siekia užpildyti išorinį elektronų sluoksnį ir tapti stabilūs, todėl jungiasi tarpusavyje. Vieni jų užpildo savo išorinį elektronų sluoksnį kitų elementų atiduotais elektronais, kiti netenka savo elektronų ir taip pat įgyja užpildytą elektronų sluoksnį (3.1.2 pav.).
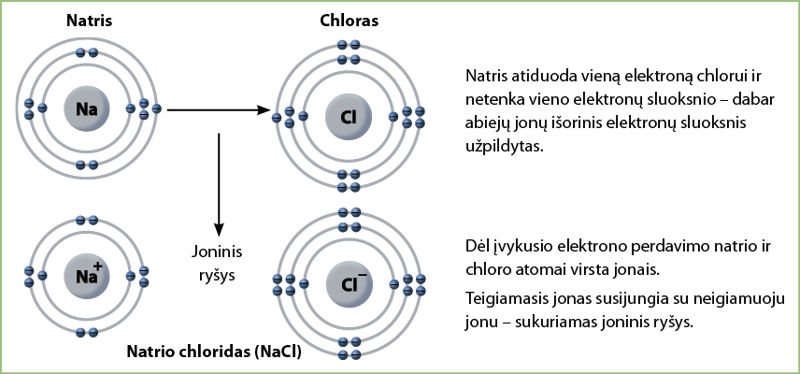
Prisiminkime natrio ir chloro sąveiką, kurią nagrinėjome 2.5 temoje. Susidarant natrio ir chloro junginiui, natrio atomo išorinio sluoksnio elektronas atiduodamas chloro atomui. Chloras prisijungia natrio išorinio sluoksnio elektroną ir taip papildo savo išorinių elektronų skaičių iki 8 (3.1.2 pav.). Tiek elektronų išoriniame sluoksnyje turi argono atomas, vadinasi, iš chloro atomo susidaręs neigiamasis jonas yra gana stabilus.
Kai vieno elemento atomo elektronai pereina kito elemento atomui ir susidaro krūvį turinčios dalelės jonai, sukuriamas jòninis ryšỹs.

Natrio atomas praranda išorinį elektroną, todėl tampa teigiamuoju natrio jonu. Kartu jis netenka vieno elektronų sluoksnio. Natrio jono išorinis elektronų sluoksnis tampa užpildytas, panašus į neono atomo išorinį sluoksnį. Chloro atomas tampa neigiamuoju jonu.
Tarp teigiamąjį krūvį turinčio natrio jono ir neigiamojo jono, gauto iš chloro atomo, sukuriamas tarpusavio ryšys – gauname natrio chlorido junginį (NaCl), kurį dažnai vadiname tiesiog valgomąja druska (3.1.3 pav.).
Elementų elektrinio neigiamumo nustatymas
Apie joninio ryšio ypatybes kalbėsime kiek vėliau. Dabar išsiaiškinkime, kodėl vieni elementai yra linkę atiduoti savo išorinio sluoksnio elektronus, o kiti – prisijungti. Tai lemia elementų prigimtis, kuri priklauso nuo atomo dydžio, elektronų skaičiaus išoriniame sluoksnyje, branduolyje esančių protonų skaičiaus ir kitų veiksnių.
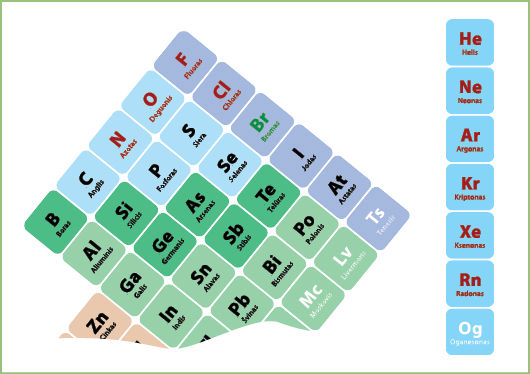
Pabandykime įsivaizduoti, kad mes perpiešiame periodinę elementų lentelę atmesdami inertinių dujų grupę (nes šios dujos nesudaro junginių), t. y. atskirdami visus VIIIA grupės elementus. Paimkime ir pasukime likusią periodinės lentelės dalį į kairę (3.1.4 pav.).
Pavaizduokime ją tarsi piramidę. Gausime štai tokį vaizdą (3.1.5 pav.).
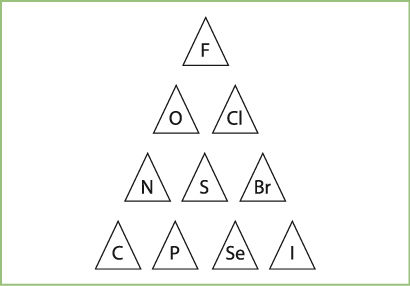
Kaip matome iš šio piešinio, piramidės viršūnėje atsiduria fluoras. Laipteliu žemiau yra deguonis ir chloras. Dar žemiau – azotas, siera ir bromas. Taip supaprastinta forma gali būti vaizduojamas labai svarbiõs elementų savybės – elektrinio neigiamùmo – skirtumas.
Elektrinis neigiamùmas yra atomo gebėjimas pritraukti kitų atomų elektronus.
Piramidės viršūnėje esančio fluoro elektrinis neigiamumas yra didžiausias, žemiau esančių elementų – mažesnis. Kitaip tariant, elementai linkę atiduoti elektronus tiems elementams, kurie šioje piramidėje yra aukščiau. Pavyzdžiui, fluoro atomas neatiduoda savo išorinio sluoksnio elektronų jokiam elementui. Deguonis savo išorinio sluoksnio elektronus atiduoda tik fluorui, tačiau gali jų prisijungti iš visų žemiau ar šalia esančių elementų. Vadinasi, tiek azoto, tiek sieros, tiek bromo atomai gali atiduoti savo išorinio sluoksnio elektronus deguonies atomui. Jei pažvelgtume į visą periodinę lentelę, pamatytume, kad lengviausiai elektronus atiduotų periodinės lentelės kairėje ir apačioje esantys elementai (3.1.6 pav.).
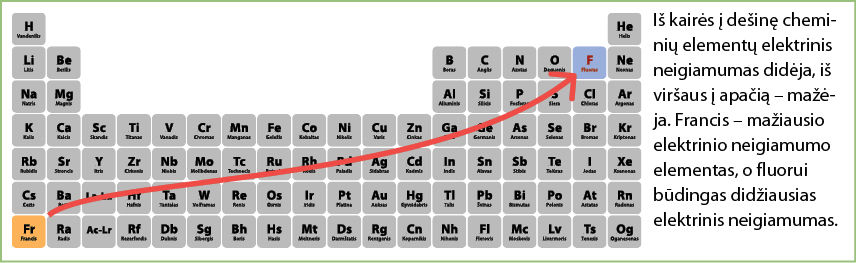
Žinoma, tai supaprastinta schema. Garsus amerikiečių mokslininkas Lainas Karlas Polingas (Linus Carl Pauling, 1901–1994) pasiūlė matematinį elektrinio neigiamumo apskaičiavimo būdą. Todėl dabar naudojamasi gana tikslia elektrinio neigiamumo reikšme (3.1.7 pav.), kuri leidžia palyginti elementus pagal jų gebėjimą pritraukti elektronus.

Didesnio elektrinio neigiamumo elementų atomai prisijungia mažesnio elektrinio neigiamumo elementų elektronus (3.1.1 lentelė).
Kaip matyti iš 3.1.1 lentelės, kai kuriais atvejais elementų elektrinio neigiamumo skirtumas yra labai didelis. Nuo šio skirtumo priklauso, koks ryšys susidaro tarp sąveikaujančių elementų. Apie tokio ryšio tipus išsamiau kalbėsime kiek vėliau.
3.1.1 lentelė. Kai kurių elementų elektrinio neigiamumo dydžiai (pagal L. K. Polingą)
Elementas | Elektrinis | Elementas | Elektrinis | Elementas | Elektrinis |
Fluoras | 3,98 | Anglis | 2,56 | Aliuminis | 1,61 |
Deguonis | 3,44 | Fosforas | 2,19 | Magnis | 1,31 |
Chloras | 3,16 | Selenas | 2,55 | Kalcis | 1,00 |
Azotas | 3,04 | Jodas | 2,66 | Litis | 0,98 |
Siera | 2,58 | Vandenilis | 2,20 | Natris | 0,93 |
Bromas | 2,96 | Silicis | 1,90 | Kalis | 0,82 |
Tai įdomu!
Lainas Karlas Polingas – garsus amerikiečių chemikas ir biochemikas. Jis du kartus pelnė Nobelio premiją: 1954 metais – už pasiekimus chemijos srityje, 1962 metais – už taikos pasaulyje stiprinimą. L. K. Polingas buvo vienas iš kvantinės chemijos pradininkų, tyrinėjo cheminio ryšio prigimtį, medžiagų sandarą, sudėtingas baltymų ir nukleorūgščių molekules. Kadangi papildomai mokėsi chemijos, į universitetą būsimasis mokslininkas buvo priimtas 15 metų, net nebaigęs vidurinės mokyklos kurso. Atestatą, kaip mokyklos garbės ženklą, jis gavo praėjus 45 metams, jau būdamas Nobelio premijos laureatas.

Klausimai ir užduotys
- Kaip paaiškintumėte elementų elektrinį neigiamumą? Kurio cheminio elemento elektrinis neigiamumas didžiausias?
- Litis gali jungtis su bromu, sudarydamas junginį. Kurio iš šių elementų atomai atiduos elektronus, o kurio – prisijungs? Nurodykite inertines dujas, į kurias pagal elektronų išsidėstymą išoriniame elektronų sluoksnyje taps panašūs jonai, susidarę iš ličio ir bromo.
- Remdamiesi 3.1.2 paveikslu, pavaizduokite schemą, kaip iš kalio ir fluoro susidaro kalio fluorido junginys. Nurodykite elektronų skaičių jonų išoriniuose sluoksniuose. Koks yra susidariusių jonų krūvis?
- 3.1.1 lentelėje raskite deguonies ir chloro elektrinio neigiamumo vertes. Kaip manote, kuris šių elementų bus linkęs prisijungti elektronus, o kuris – atiduoti? Kiek daugiausia elektronų gali atiduoti mažesnio elektrinio neigiamumo elementas?
- Magnis gali atiduoti du elektronus, o deguonis gali juos prisijungti. Nupieškite gautų dalelių – jonų – elektronų išsidėstymą sluoksniais.
Ko išmokome?
- Sudarydami junginius tarpusavyje vieni elementai prisijungia elektronus, kiti atiduoda. Atomo gebėjimas prisijungti elektronus vadinamas elektriniu neigiamumu.
- Kuo didesnis atomo elektrinis neigiamumas, tuo lengviau jam prisijungti elektronus.
- Didžiausias elektrinis neigiamumas būdingas elementams, esantiems periodinės elementų lentelės dešinėje ir viršuje, o mažiausias – išdėstytiems apačioje ir kairėje.
- Atomas geba prisijungti tiek elektronų, kad jo išorinis sluoksnis taptų stabilesnis – panašus į inertinių dujų išorinį elektronų sluoksnį.
- Atiduodamas ir prisijungdamas elektronus atomas virsta jonu.
- Kai vieno elemento atomo elektronai pereina kito elemento atomui ir susidaro krūvį turinčios dalelės jonai, sukuriamas joninis ryšys.


