Atominis masės vienetas
Nagrinėjome izotopų ir
2 Atominis masės vienetas gali būti žymimas viena raide u (nuo žodžio „vienetas“, angl. unit). Kartais atominis masės vienetas vadinamas daltonu ir žymimas Da.
(2.2.1)
Atomo masę padaliję iš 1/12 m(
Ar(6Li) = 6,015122;
Ar(7Li) = 7,016004.
Izotopų santykinė atominė masė yra trupmeniniai skaičiai, tiesa, labai artimi sveikiesiems. Vienintelio anglies-12 izotopo
Masių spektrometras
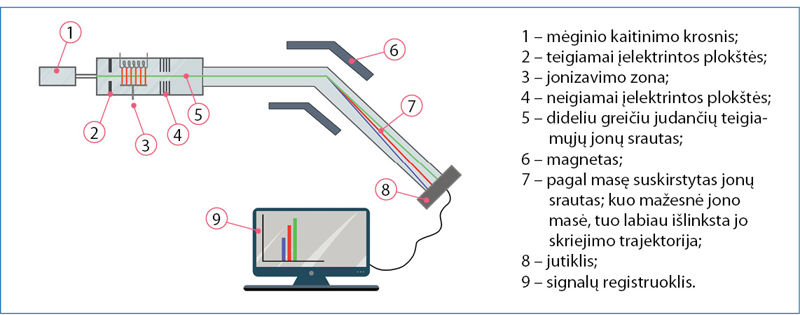
Atomų ir molekulių masė nustatoma mãsių spektrometrù (2.2.2 pav.). Tiriamoji medžiaga pirmiausia paverčiama dujinės būsenos teigiamaisiais jonais, kurių judėjimą galima valdyti elektriniu ir magnetiniu laukais. Pavyzdžiui, ličio mėginys įkaitinamas tiek, kad medžiaga išgaruotų – gauti garai įpučiami į masių spektrometrą ir yra veikiami didelės energijos elektronų srautu. Kai greitai skriejantis elektronas atsitrenkia į ličio atomą, jo energijos pakanka išmušti ličio elektronui ir ličio atomui paversti jonu.
Kairiojoje ir dešiniojoje lygties pusėse užrašyti elektronai skiriasi turima energija. Dalis atsitrenkiančio elektrono energijos sunaudojama įveikti traukai tarp ličio elektrono ir branduolio.
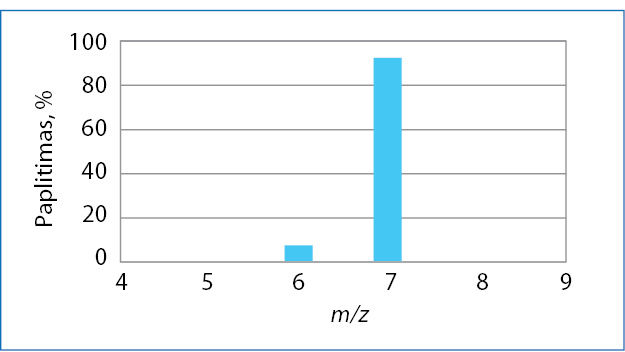
Patekę tarp įelektrintų spektrometro plokščių, ličio jonai priverčiami skrieti dideliu greičiu ir nukreipiami tarp elektromagneto polių. Dėl sąveikos su magnetiniu lauku keičiasi jonų skriejimo kryptis. Magnetiniame lauke jie juda lanku. Nuokrypis nuo tiesios trajektorijos priklauso nuo jonų masės ir krūvio santykio m/z. Paprastai spektrometras yra suderintas taip, kad susidarytų tik vienakrūviai jonai, t. y. z = 1. Skirtingos masės jonai patenka į skirtingas jutiklio vietas. Jeigu į prietaisą įleidžiama ličio garų, jonai į jutiklį atsitrenkia dviejose vietose. Vadinasi, litis sudarytas iš dviejų izotopų. Matavimo rezultatai pateikiami stulpeline diagrama (2.2.3 pav.).
Klausimai ir užduotys
- Paaiškinkite, kodėl vienintelio
C 12 - Išnagrinėkite gamtinio titano masių spektro diagramą.
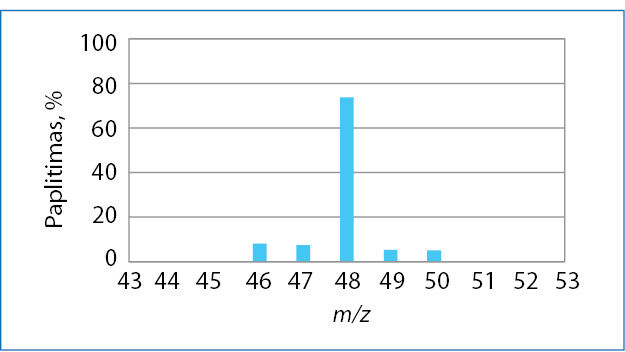
- Kiek titano izotopų yra gamtoje?
- Kurio iš titano izotopų aptinkama daugiausia? Parašykite šio izotopo simbolį, nurodykite masės ir atominį skaičių.
- Kiek apytiksliai procentų visų titano atomų sudaro šis labiausiai paplitęs izotopas?
- Masių spektrometru ištyrus chloro mėginį, sužinota, kad 75,8 % jo atomų sudaro chloras-35, o 24,2 % – chloras-37. Sudarykite stulpelinę diagramą, kuria būtų parodyti šie masių spektrometru gauti rezultatai.
- Idėja atomų masę išreikšti santykiniais vienetais kilo Džonui Daltonui (John Dalton, 1766–1844). Pirmąją atominių masių lentelę jis sudarė atsižvelgdamas į tai, kokiu masių santykiu reaguoja medžiagos. Pavyzdžiui, dideliame deguonies pripildytame inde sudeginus 0,15 g magnio, gaunama 0,25 g magnio oksido. Apskaičiuokite arba nurodykite:
- kiek gramų deguonies prisijungė magnis;
- kurie atomai – magnio ar deguonies – yra sunkesni, jei vienas magnio atomas prisijungia vieną deguonies atomą;
- koks yra magnio ir deguonies atomų masių santykis, remiantis čia aprašyto bandymo duomenimis, ir koks – remiantis periodine lentele; palyginkite abiem būdais gautus rezultatus.
- Protono santykinė masė 1,007, o elektrono santykinė masė 5,48 · 10–4. Kelių elektronų masė yra lygi vieno protono masei?
