Ketvirtojo periodo elementų elektroninė sandara
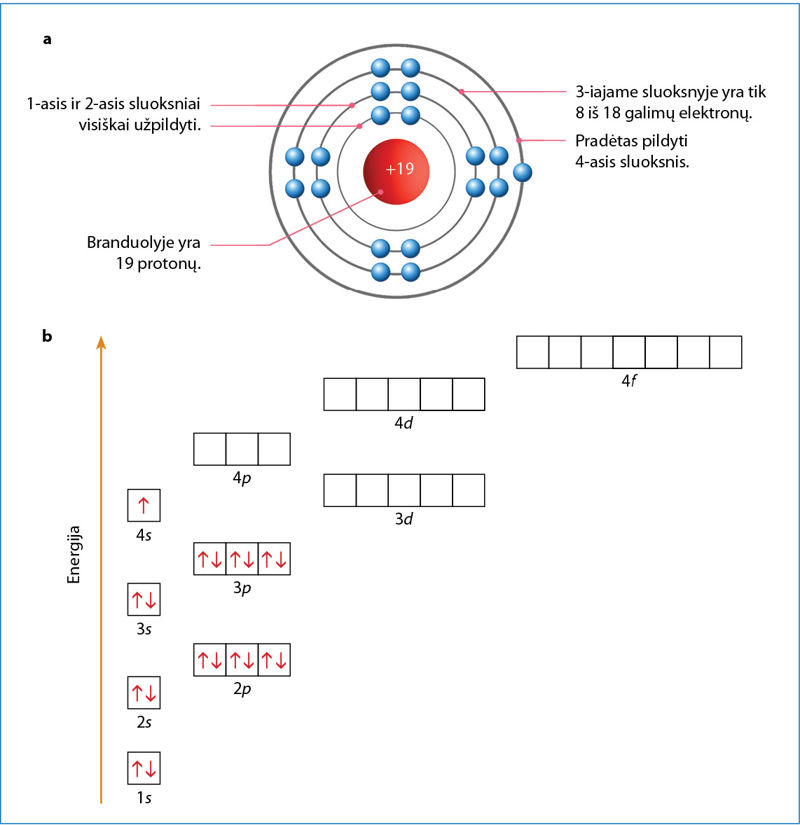
Pirmųjų trijų periodų elementams galioja paprasta taisyklė – aukštesnis elektronų sluoksnis pradedamas pildyti tik tada, kai visiškai užpildomas žemesnis. Pradedant nuo ketvirtojo periodo, sluoksnių pildymo tvarka sudėtingesnė. Po 3p orbitalių pirmiausia pildomos 4s orbitalės ir tik tada tęsiamas trečiojo sluoksnio orbitalių pildymas elektronais. Išnagrinėkime kalio atomo elektroninę sandarą (2.7.1 pav.). Tai ketvirtojo periodo elementas, tad jo elektronai išsidėsto 4 sluoksniais. Pirmasis ir antrasis sluoksniai yra visiškai užpildyti. Juose yra atitinkamai 2 ir 8 elektronai. Ketvirtajame sluoksnyje, kaip ir dera 1-osios grupės elementui, yra 1 elektronas (4s1). Trečiajame sluoksnyje yra 8 iš 18 galimų elektronų (užpildytos tik s ir p orbitalės). Nors trečiasis sluoksnis dar tik iš dalies užpildytas, prasidėjo ketvirtojo sluoksnio pildymas.
Ketvirtojo sluoksnio pildymas elektronais prasideda dar nevisiškai užpildžius trečiąjį sluoksnį.
2.5 lentelė. Ketvirtojo periodo elementų elektroninė sandara
Elemento | Elektroninė formulė, kuria | Pastabos | |
išsidėstymas | išsidėstymas | ||
K | 2, 8, 8, 1 | [Ar] 4s1 | Pradedamas pildyti ketvirtasis sluoksnis. Trečiajame sluoksnyje aštuoni elektronai. |
Ca | 2, 8, 8, 2 | [Ar] 4s2 | |
Sc | 2, 8, 9, 2 | [Ar] 3d1 4s2 | Pildomas trečiasis sluoksnis. Ketvirtajame sluoksnyje du elektronai. |
Ti | 2, 8, 10, 2 | [Ar] 3d2 4s2 | |
V | 2, 8, 11, 2 | [Ar] 3d3 4s2 | |
Cr | 2, 8, 13, 1 | [Ar] 3d5 4s1 | Vienas elektronas iš 4s orbitalės peršoka į 3d orbitalę. Atomas įgyja simetrišką 3d orbitalių užpildymą. |
Mn | 2, 8, 13, 2 | [Ar] 3d5 4s2 | Pildomas trečiasis sluoksnis. Ketvirtajame sluoksnyje du elektronai. |
Fe | 2, 8, 14, 2 | [Ar] 3d6 4s2 | |
Co | 2, 8, 15, 2 | [Ar] 3d7 4s2 | |
Ni | 2, 8, 16, 2 | [Ar] 3d8 4s2 | |
Cu | 2, 8, 18, 1 | [Ar] 3d10 4s1 | Vienas elektronas iš 4s orbitalės peršoka į 3d orbitalę. Atomas įgyja simetrišką 3d orbitalių užpildymą. |
Zn | 2, 8, 18, 2 | [Ar] 3d10 4s2 | Trečiasis sluoksnis visiškai užpildytas. Jame 18 elektronų. Tęsiamas ketvirtojo sluoksnio pildymas. |
Ga | 2, 8, 18, 3 | [Ar] 3d10 4s2 4p1 | |
Ge | 2, 8, 18, 4 | [Ar] 3d10 4s2 4p2 | |
As | 2, 8, 18, 5 | [Ar] 3d10 4s2 4p3 | |
Se | 2, 8, 18, 6 | [Ar] 3d10 4s2 4p4 | |
Br | 2, 8, 18, 7 | [Ar] 3d10 4s2 4p5 | |
Kr | 2, 8, 18, 8 | [Ar] 3d10 4s2 4p6 | |
6 Kartais ketvirtojo periodo elementų elektroninės formulės rašomos laikantis orbitalių pildymo tvarkos, t. y. pirma užrašoma 4s orbitalė, tada 3d. Kai pereinamųjų elementų atomai virsta jonais, pirmiausia jie netenka 4s orbitalės elektronų, todėl parankesnės tokios elektroninės formulės, kokios parašytos šioje lentelėje.
Ketvirtojo periodo elementų elektronų išsidėstymas sluoksniais pateiktas 2.5 lentelėje. Matome, kad nuo 3-iosios grupės elemento skandžio vėl pradeda didėti trečiojo sluoksnio elektronų skaičius, o ketvirtojo sluoksnio pildymas sustoja. 3–12 grupių elementai, kurie skiriasi elektronų skaičiumi priešpaskutiniame sluoksnyje, vadinami péreinamaisiais7. Visi šie elementai yra metalai.
7 Dėl sąvokos „pereinamieji elementai“ taikymo nėra vieningo sutarimo. Kartais 12 grupės elementai nepriskiriami pereinamiesiems. Pagal griežtesnę klasifikaciją pereinamaisiais vadinami tik tie elementai, kurie būdami jonais turi neužpildytų 3d orbitalių. 12-osios grupės elemento cinko jonų 3d orbitalės visiškai užpildytos, todėl ir siūloma jo nelaikyti pereinamuoju.
Atkreipkite dėmesį į chromo ir vario elektronines formules. Jie išoriniame, ketvirtajame, sluoksnyje turi tik po 1 elektroną. Vienas elektronas iš 4s orbitalės pereina į 3d orbitalę. Dėl tokios transformacijos atomai įgyja simetriškai užpildytas visas d orbitales: chromo d5 (kiekvienoje d orbitalėje po vieną elektroną) ir vario d10 (kiekvienoje d orbitalėje po du elektronus). Dėl orbitalių tarpusavio sąveikos toks simetriškas d orbitalių užpildymas yra stabilesnis. Toks persitvarkymas įvyksta, kai iki simetriško išsidėstymo trūksta tik vieno elektrono.
5, 6 ir 7 perioduose sluoksnių pildymo elektronais tvarka dar sudėtingesnė, tad, norint išsiaiškinti šių periodų elementų elektroninę sandarą, būtina naudotis papildoma informacija.
Klausimai ir užduotys
- Orbitalių ir didžiausią elektronų skaičių sluoksnyje galima apskaičiuoti naudojantis paprastomis matematinėmis formulėmis. Kiek orbitalių yra ketvirtajame sluoksnyje? Kiek daugiausia šiame sluoksnyje gali būti elektronų?
- Kiek daugiausia elektronų gali būti trečiajame sluoksnyje, jeigu jis yra:
- paskutinis sluoksnis, kuriame yra elektronų;
- ne paskutinis (elektronų yra ir tolesniuose sluoksniuose).
- Kuo išsiskiria chromo ir vario elektroninė sandara?
- Sudarykite taškines (Luiso) formules: a) germanio; b) seleno. Su kurių antrojo periodo elementų Luiso formulėmis šios sutampa?
- Toliau pateikti trijų atomų pavadinimai. Nurodykite, kurio jų sluoksnio ir kurių orbitalių elektronai yra valentiniai:
- anglis;
- fosforas;
- berilis.
- Ketvirtojo periodo pereinamųjų elementų valentiniai elektronai išsidėstę dviejuose sluoksniuose. Jiems priklauso paskutinio sluoksnio s orbitalės ir priešpaskutinio sluoksnio d orbitalių elektronai. Kiek valentinių elektronų turi:
- skandis;
- vanadis;
- chromas?
Kaip šių atomų valentinių elektronų skaičius susijęs su grupės numeriu?

