Santrauka
Nuosekliai didėjant elemento atominiam skaičiui, t. y. protonų skaičiui branduolyje, elektronų skaičius išoriniame sluoksnyje kinta periodiškai – didėja iki aštuonių (tik pirmojo periodo iki dviejų), tada atsiranda naujas sluoksnis, ir elektronų skaičius jame pradeda iš naujo didėti. Elektroninės sandaros periodiškumas lemia elementų savybių periodinį pasikartojimą (daugiau apie tai – IV skyriuje).
1 amv (atominės masės vieneto) masė lygi 1/12 anglies-12 atomo masės.
Santykinė atominė masė rodo, kiek kartų atomo masė didesnė už 1 a. m. v. masę.
Izotopo santykinė masė nustatoma masių spektrometru.
Elemento santykinė atominė masė yra jo gamtinių izotopų santykinių atominių masių svertinis vidurkis, apskaičiuotas atsižvelgiant į izotopų paplitimą gamtoje.
Atomo elektronai išsidėsto sluoksniais. Sluoksnio numeris n vadinamas pagrindiniu kvantiniu skaičiumi.
Sluoksnį sudaro n2 orbitalių. Kadangi kiekvienoje orbitalėje gali būti ne daugiau kaip du elektronai, sluoksnyje gali būti ne daugiau kaip 2n2 elektronų.
Orbitalės skiriasi savo forma ir energija.
Elektronai turi ne tik neigiamąjį elektros krūvį, bet ir magnetinį lauką. Elektronų porą sudaro tik priešingų sukinių (turintys priešingai nukreiptą magnetinį lauką) elektronai.
Vienodos energijos orbitalės pirmiausia užpildomos pavieniais elektronais. Elektronų poros susidaro, jei nebelieka tuščių tos pačios energijos orbitalių.
Trečiojo sluoksnio pildymas elektronais vyksta dviem etapais. Pirmiausia užpildomos tik 3s ir 3p orbitalės, vėliau – 4s orbitalė, ir tik tada pradeda gausėti elektronų 3d orbitalėse.
3d orbitalių pildymas elektronais prasideda nuo skandžio. Elementai, kurių elektroninė sandara susijusi su 3d orbitalių pildymu, vadinami pereinamaisiais.
Iš pereinamųjų elementų išskirtinė yra chromo ir vario elektroninė sandara. Šie elementai turi tik po vieną elektroną 4s orbitalėje.
Dėl cheminių reakcijų branduolių sudėtis nekinta, ji gali pakisti tik vykstant branduolinėms reakcijoms.
Dalies atomų branduoliai yra nepatvarūs, jiems būdingas savaiminis radioaktyvusis skilimas.
Praktinė užduotis
Liepsnos testas
Kai kurios liepsnos įkaitintos medžiagos ima švytėti tam tikra spalva ir nudažo liepsną. Tai vadinama liepsnos testu. Atliekant tyrimą naudojamas degiklis ir karšta viela, todėl reikia būti atsargiems, kad nenusidegintumėte. Dėl saugumo šį tyrimą geriau atlikti kaip demonstracinį, kartu su visa klase.
Reikės
Spiritinės lemputės arba dujų degiklio, 15–20 cm ilgio nichromo vielos, replių, druskos rūgšties tirpalo (50 ml koncentruotos druskos rūgšties praskiedžiama įpylus 50 ml distiliuoto vandens), po 1–2 ml įvairių druskų vandeninių 1–2 mol/l koncentracijos tirpalų (tinka natrio, kalcio, stroncio, ličio, bario chloridai arba nitratai; galite išbandyti ir kitų metalų druskas).
Tyrimo žingsniai
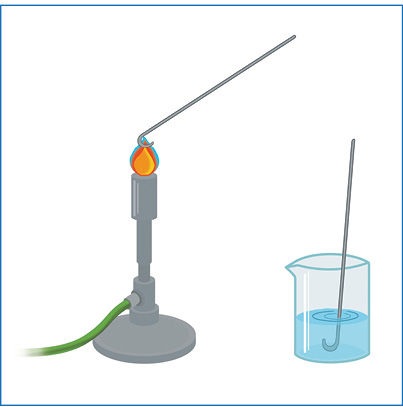
- Replėmis sulenkite nichromo vielos galą taip, kad susidarytų nedidelė 2–3 mm skersmens kilpelė. Kitą vielos galą pritvirtinkite prie kokio nors laikiklio.
- Uždekite dujų degiklį arba spiritinę lemputę ir karščiausioje liepsnos dalyje kaitinkite vielos kilputę, kol ši taps raudona (1 pav.). Panardinkite karštą vielos kilputę į druskos rūgšties tirpalą. Dar kartą įkaitinkite ir vėl panardinkite į druskos rūgšties tirpalą. Kartokite tol, kol kilputė nebekeis liepsnos spalvos.
- Panardinkite ataušintą kilputę į vieną iš druskų tirpalų ir vėl kaitinkite. Stebėkite ir užsirašykite liepsnos spalvą.
- Prieš bandant kitos druskos tirpalą kilputę reikia nuvalyti. Tai daroma vėl kartojant 2 ir 3 žingsnius.
Šį tyrimą galima atlikti kiek kitu būdu. Jei turite indelių su purkštukais, galima į liepsną įpurkšti tiriamojo tirpalo.
Diskusija
Aptarkite, kur praktikoje gali būti pritaikytas liepsnos nuspalvinimo reiškinys. Naudodami jums prieinamus informacijos šaltinius išsiaiškinkite, kodėl įkaitinta medžiaga skleidžia tam tikros spalvos šviesą, kaip tai susiję su elektronų pasiskirstymu orbitalėse. Pasidalykite savo rasta informacija su bendraklasiais.
Papildomos užduotys
- Nustatykite, kurio elemento elektronų pasiskirstymas sluoksniais yra:
- 2, 8, 2
ats.: ; - 2, 8, 8, 1
ats.: ; - 2, 8, 6
ats.: .
- Nustatykite, kurio elemento elektroninė formulė yra:
- 1s22s22p5
ats.: ; - 1s22s22p63s23p1
ats.: ; - 1s22s22p63s23p3
ats.: .
- Trečiasis periodas baigiasi argonu, turinčiu tris elektronų sluoksnius. Apskaičiuokite, kiek daugiausia elektronų gali būti trečiajame sluoksnyje, ir nustatykite, ar šis argono atomo sluoksnis jau užpildytas.
Trečiajame sluoksnyje daugiausia gali būti elektronų.
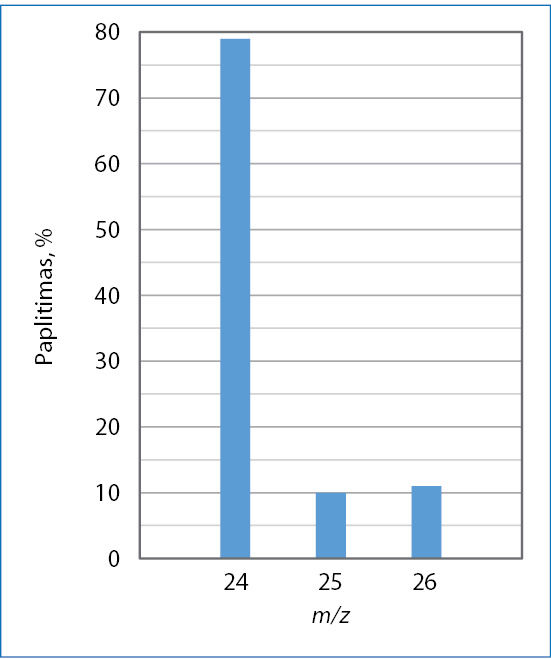
- Masių spektrometru ištyrus magnio mėginį, gautas jo masių spektras (2 pav.)
- Parašykite gamtoje randamų magnio izotopų simbolius, nurodykite masės ir atominį skaičių. Parašykite, kiek kiekvienas izotopas turi protonų, neutronų ir elektronų.
- Apskaičiuokite apytikslę magnio santykinę atominę masę. Laikykite, kad izotopo santykinė atominė masė sutampa su masės skaičiumi. Atsakymą pasitikrinkite periodinėje lentelėje.
- Kad būtų paprasčiau, b) dalyje padarėme prielaidą, kad izotopo atominė masė sutampa su masės skaičiumi. Apibūdinkite masės skaičiaus ir izotopo santykinės atominės masės skirtumą. Paaiškinkite, kodėl ši prielaida nedaro didelės įtakos apskaičiuojant elemento santykinę atominę masę.
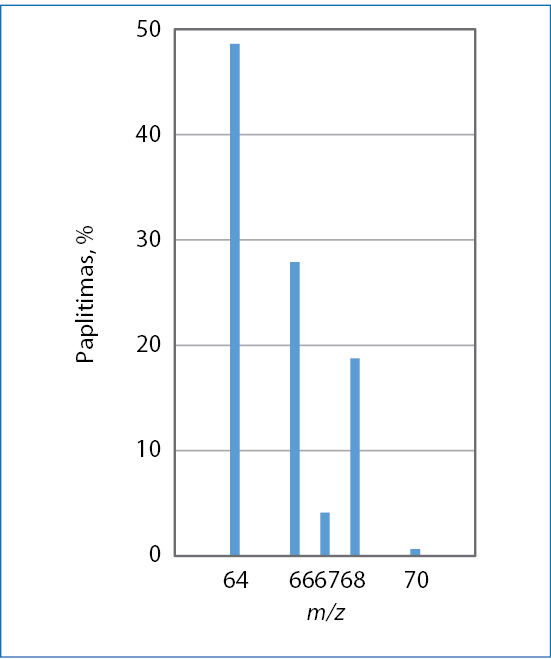
- Panagrinėkite 3 paveikslą, kuriame pateiktas gamtinio cinko masių spektras.
- Kelių izotopų mišinys yra gamtinis cinkas?
- Parašykite mažiausiai paplitusio cinko izotopo simbolį, nurodykite atominį ir masės skaičių.
- Iš cinko pagamintos detalės masė 65,38 g. Apskaičiuokite šioje detalėje esančių cinko-66 atomų skaičių.
Ats.: ≈
- Germanis yra retas elementas, aptinkamas kaip sidabro, švino, cinko rūdų priemaiša. Dėl puslaidininkio savybių naudojamas elektronikos prietaisų gamybai. Šio elemento elektroninė formulė [Ar] 3d104s24p2. Informacija apie jo gamtinius izotopus pateikta 1 lentelėje.
- Germanio elektroninėje formulėje yra simbolis [Ar]. Ką jis rodo?
- Parašykite jonų Ge2+ ir Ge4+ elektronines formules (nurodykite ir elektronų pasiskirstymą orbitalėse).
Ats.:
- Sudarykite stulpelinę diagramą, kuria būtų parodytas gamtinio germanio masių spektras.
- Apskaičiuokite germanio-76 atomų skaičių 0,120 mol gamtinio germanio mėginyje. Vienas gamtoje randamų germanio junginių – germanio(IV) sulfidas. Jį kaitinant ore gaunamas germanio(IV) oksidas, o šį veikiant vandenilio dujomis susidaro germanis. Vyksta tokios reakcijos:
GeS2 + 3O2 → GeO2 + 2SO2;
GeO2 + 2H2 → Ge + 2H2O.
Ats.:
- Apskaičiuokite germanio(IV) sulfido, reikalingo gaminant 1,00 kg germanio, masę. Jo išeiga 85,0 %.
1 lentelė. Germanio izotopai
Izotopas | |||||
Santykinė atominė masė | 69,924 | 71,922 | 72,923 | 73,921 | 75,921 |
Paplitimas, % | 20,57 | 27,45 | 7,75 | 36,50 | 7,73 |
Ats.: kg.
- Mokiniams reikėjo paaiškinti cheminio elemento sąvoką. Vienas mokinys teigė, kad elementas nusakomas protonų skaičiumi, kitas – jog neutronų skaičiumi, o trečiojo nuomone, elektronų skaičiumi. Išnagrinėkite, kiek kiekvienas atsakymų teisingas. Savo atsakymą paaiškinkite.
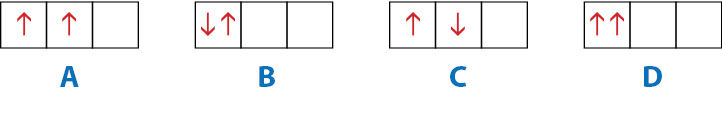
- Kuriuo atveju teisingai nurodyta, kaip du elektronai užima p orbitales. Paaiškinkite, kokie dėsningumai pažeisti kitais atvejais.
- Ištyrus meteoritą sužinota, kad jo geležies izotopinė sudėtis skiriasi nuo Žemėje esančios. 20,0 % atomų yra geležies-54, likusieji – geležies-56. Apskaičiuokite meteorito geležies izotopų santykinės masės svertinį vidurkį. Laikykite, kad masės skaičius sutampa su santykine izotopo mase.
Ats.: .
- Gamtinis kalis yra trijų izotopų mišinys. Vienas jų – kalis-40 – radioaktyvus. Tad su daug kalio turinčiais produktais gauname ir šiek tiek padidintą radioaktyviosios spinduliuotės dozę. Kalio-40 atomai sudaro 0,012 % visų kalio atomų skaičiaus. Vidutinio dydžio banane bendra kalio masė yra apie 400 mg.
- Apskaičiuokite radioaktyviojo kalio atomų skaičių viename banane.
Ats.:
- Radioaktyvusis kalis skyla gana lėtai. Jo pusėjimo trukmė – 1,25 milijardo metų. Paaiškinkite, ką rodo pusėjimo trukmė. Kurie radioaktyvieji izotopai pavojingesni – kurių pusėjimo trukmė trumpa ar kurių ilga? Paaiškinkite savo atsakymą.
- Iridis yra dviejų izotopų mišinys: 191Ir (Ar = 190,960) ir 193Ir (Ar = 192,962). Apskaičiuokite šių izotopų paplitimą procentais. Trūkstamos informacijos ieškokite periodinėje lentelėje.
Ats.: ir .
- Renis yra dviejų izotopų mišinys: 185Re (Ar = 184,952) ir 187Re (Ar = 186,955). Apskaičiuokite šių izotopų paplitimą procentais. Trūkstamos informacijos ieškokite periodinėje lentelėje.
Ats.: ir .
- Buitiniuose jonizaciniuose dūmų jutikliuose (žr. 2.8.7 pav.) naudojamas americio-241 oksidas AmO2. Americio gamtoje nėra, tai dirbtinis elementas. Americio-241 izotopas susidaro branduoliniuose reaktoriuose kaip šalutinis produktas. Dūmų jutiklyje yra 0,50 µg americio-241 (µg – mikrogramas; 1 µg = 1 · 10–6 g). Americio-241 pusėjimo trukmė – 432 metai.
- Americis skildamas išspinduliuoja alfa dalelę. Koks izotopas susidaro po šio virsmo?
Ats.: .
- Kokia bus jutiklyje naudoto americio-241 masė po 864 metų?
Ats.:
- Paaiškinkite, kodėl panaudoto jonizacinio dūmų jutiklio nevalia ardyti, jį privalu atiduoti perdirbti.
