Dvigubasis kovaleñtinis ryšỹs, kovaleñtinis tiñklas, kovaleñtinis kristãlas, alotròpinė atmainà, vieninė medžiagà, formulinis vienetas.
Kovalentinis ryšys: ne tik molekulės
Anglis ir silicis sudaro oksidus CO2 ir SiO2. Galima pamanyti, kad šių oksidų savybės panašios, mat jie abu yra periodinės lentelės 14 (IVA) grupės elementai. Žinome, kad tos pačios grupės elementai turi daug panašumų. Išties jie abu yra rūgštiniai oksidai, abiejuose yra kovalentiniai poliniai ryšiai. Bet jų fizikinės savybės skirtingos. Anglies dioksidas yra viena iš mūsų iškvepiamo oro sudedamųjų dalių. Silicio dioksidas yra viena iš smėlio sudėtinių dalių. Anglies dioksidas virsta dujomis –78 °C temperatūroje. Silicio dioksidas išsilydo esant 1713 °C temperatūrai, o dujomis virsta tik įkaitintas beveik iki 3000 °C. Toks šių medžiagų agregatinės būsenos skirtumas susijęs su jų sandaros ypatumais.
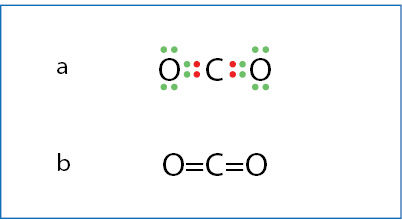
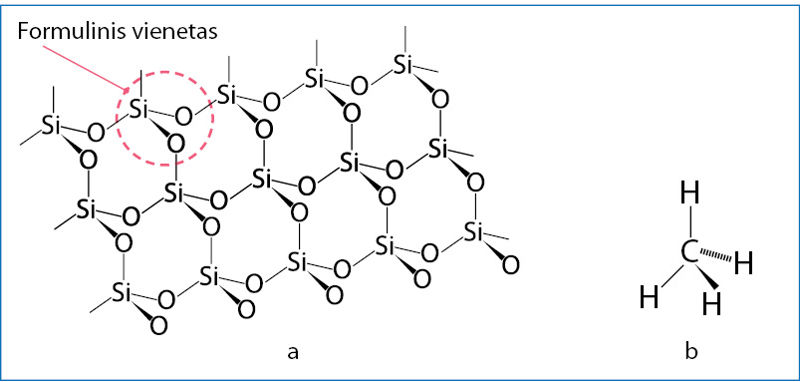
Anglies dioksido molekulėje yra du dvigubieji kovalentiniai poliniai ryšiai (3.3.1 pav.). Silicio dioksidas, nors ir kovalentinis junginys, sudarytas ne iš molekulių. Užrašas SiO2 rodo tik formulinį vienetą. Kiekvienas silicio atomas viengubaisiais ryšiais susijungęs su keturiais deguonies atomais. Savo ruožtu kiekvienas deguonies atomas dviem viengubaisiais kovalentiniais ryšiais susijungęs su dviem skirtingais silicio atomais (3.3.2 pav.). Silicio dioksidas sudaro kovaleñtinį kristãlą, kuriame visi atomai kovalentiniais ryšiais sujungti į vientisą trimatį tiñklą.
Nuo ko priklauso medžiagos virimo ir lydymosi temperatūra?
Kai keičiasi molekulinės sandaros medžiagų agregatinė būsena, jų molekulių sudėtis nekinta, kovalentiniai ryšiai išlieka nepakitę. Tiek kietosios, tiek skystosios, tiek dujinės būsenos metanas sudarytas iš CH4 molekulių (3.3.2 pav., b).
Tarkime, esant –200 °C temperatūrai, turime kietosios būsenos metaną. Jo kristalas sudarytas iš tvarkingai surikiuotų molekulių. Molekulės negali pakeisti savo buvimo vietos. Tarp molekulių veikia silpna tarpmolekulinė trauka (tarpmolekulinius ryšius nagrinėsime šiek tiek vėliau). Pakanka medžiagos temperatūrai pakilti iki –182 °C, ir kristalas suyra, molekulės išsilaisvina, pradeda judėti, medžiaga virsta skysčiu. Temperatūrai pakilus iki –162 °C, molekulės galutinai nutolsta viena nuo kitos – medžiaga virsta dujomis.
Norint išlydyti silicio dioksidą (3.3.2 pav., a), reikia nutraukti dalį kovalentinių ryšių. Kovalentiniai ryšiai yra tvirti, jiems nutraukti reikia daug energijos. Todėl lydymosi temperatūra tokia aukšta.
Norint išlydyti joninės sandaros medžiagas, pavyzdžiui, natrio chloridą (3.1 temos 3.1.3 pav.), reikia nutraukti joninius ryšius. Šie ryšiai, kaip ir kovalentiniai, yra tvirti. Tad joninės medžiagos lydosi aukštoje temperatūroje.
Tikrai ne visos kovalentinės molekulinės sandaros medžiagos lydosi ir verda esant minusinei temperatūrai. Vanduo verda +100 °C temperatūroje. Gliukozė išsilydo esant +146 °C temperatūrai, o dujomis gliukozės paversti net nepavyksta. Ji suskyla.
Taigi iš molekulių sudarytų medžiagų agregatinė būsena kinta santykinai žemoje temperatūroje. Molekulių nesudarančios medžiagos (joninės ir sudarančios kovalentinius tinklus) išsilydo ir verda santykinai aukštoje temperatūroje (3.1 lentelė).
3.1 lentelė. Skirtingos sandaros medžiagų fizikinės savybės
Medžiagos pavadinimas ir formulė | Lydymosi temperatūra, °C | Virimo temperatūra, °C | Medžiagos sandaros apibūdinimas |
Metanas CH4 | –182 | –162 | Sudaryta iš molekulių |
Anglies dioksidas CO2 | –78 °C temperatūroje sublimuojasi (kietoji medžiaga virsta dujomis). | Sudaryta iš molekulių | |
Silicio dioksidas SiO2 | +1713 | +2950 | Kovalentinis kristalas, kovalentinių ryšių tinklas |
Natrio chloridas NaCl | +801 | +1465 | Joninis kristalas, joninių ryšių tinklas |
Medžiagos lydymosi ir virimo temperatūra priklauso nuo to, kokio stiprumo trauką tarp dalelių reikia įveikti.
- Jei būsenos kitimas susijęs su tarpmolekulinių ryšių nutraukimu (kaip metano, vandens, gliukozės), toks kitimas įvyksta esant santykinai žemai temperatūrai.
- Jei būsenos kitimas susijęs su joninių ar kovalentinių ryšių nutraukimu (kaip natrio chlorido, silicio dioksido), toks kitimas įvyksta esant aukštai temperatūrai.
Deimantas ir grafitas
Ko gero, geriausiai jums žinomos nemolekulinės sandaros kovalentinės medžiagos yra deimantas ir grafitas (3.3.3 pav.). Abi šios medžiagos yra anglies alotròpinės ãtmainos – to paties elemento skirtingos sandaros vieninės mẽdžiagos (sudarytos tik iš vieno elemento atomų).
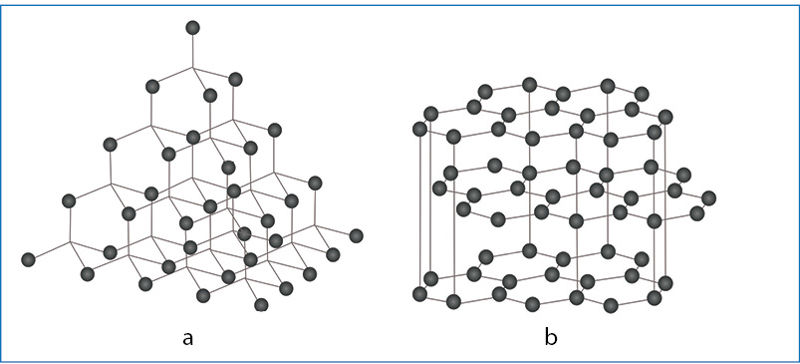
Visi deimanto kristalo atomai sujungti į vieną trimatį tinklą. Atstumai tarp anglies atomų (ryšio ilgis) deimante yra 154 pm. Kovalentiniai ryšiai tarp anglies atomų labai tvirti, todėl deimantas yra kiečiausia iš medžiagų. Grafitas yra sluoksniuotos sandaros. Vieno sluoksnio anglies atomai sujungti tvirtais kovalentiniais ryšiais. Atstumai tarp jų yra 142 pm. Atstumas tarp sluoksnių gerokai didesnis – 335 pm. Trauka tarp sluoksnių silpna. Todėl išilgai sluoksnių grafitą galima deformuoti, sluoksniai tarsi slysta vienas kitu. Dar viena išskirtinė grafito savybė – jis laidus elektros srovei.
3.2 lentelė. Bendriausios skirtingos sandaros medžiagų savybės
Joniniai junginiai | Kovalentiniai junginiai | ||
Molekulinės sandaros | Nemolekulinės sandaros | ||
Pavyzdžiai | NaCl, K2O, Ca(OH)2, KNO3 | H2O, CH4, NO2, NH3, HCl, C12H22O11 | SiO2, deimantas, grafitas |
Iš ko sudaryta medžiaga | Iš jonų. Kristalą sudaro milžiniškas skaičius į vieną darinį sujungtų, tvarkingai išsidėsčiusių jonų. Skirtingo dydžio kristaluose jonų skaičius skirtingas. | Iš molekulių. Molekulę sudaro tiksliai apibrėžtas atomų skaičius (pavyzdžiui, cukraus molekulę sudaro 45 atomai). Kai medžiaga yra kietosios būsenos, kristalai sudaryti iš tvarkingai išsidėsčiusių molekulių. | Iš milžiniško skaičiaus kovalentiniais ryšiais į vieną kristalą sujungtų atomų. Skirtingo dydžio kristaluose atomų skaičius skirtingas. |
Lydymosi temperatūra | Aukšta. Kambario temperatūroje būna kietosios agregatinės būsenos. | Santykinai žema | Labai aukšta. Kambario temperatūroje – kietosios medžiagos. |
Kietumas | Trapios, kietos | Būna įvairių | Trapios, labai kietos |
Tirpumas | Dalis tirpsta vandenyje ir kituose poliniuose tirpikliuose. Netirpsta nepoliniuose tirpikliuose. | Vienos tirpsta poliniuose, kitos nepoliniuose tirpikliuose. | Netirpsta nei poliniuose, nei nepoliniuose tirpikliuose. |
Laidumas elektros srovei | Kietosios būsenos nelaidžios. Išlydytos laidžios. Vandeniniai tirpalai laidūs. | Didžioji dauguma nelaidžios. Tik nedidelės dalies medžiagų (pvz., NH3, HCl) tirpalai laidūs. | Paprastai nelaidžios. Grafitas laidus. |
Koks ryšys susidarys – joninis ar kovalentinis?
Kodėl vieni atomai netenka elektronų, o kiti sudaro bendrąsias poras? Ryšio tipą lemia tai, kiek stipriai branduolys traukia valentinius elektronus. Nagrinėdami elementų atomų sudaromų ryšių pavyzdžius aptarėme chloro sąveiką su natriu (susidaro jonai) ir chloro sąveiką su siera (susidaro bendrosios elektronų poros). Natris, siera ir chloras yra trečiojo periodo elementai. Visų jų elektronai išsidėstę trimis sluoksniais. Kai sluoksnių skaičius vienodas, išoriniai elektronai traukiami tuo stipriau, kuo didesnis branduolio krūvis. Natrio atome elektronus traukia branduolys, kurio krūvis +11. Chloro branduolio krūvis gerokai didesnis, +17. Dėl stipresnės traukos chloro išorinio sluoksnio elektronai pritraukiami arčiau branduolio. Chloro atomas yra beveik dvigubai mažesnis už natrio atomą. Susidūrus šiems dviem atomams, natrio valentinis elektronas yra arčiau chloro branduolio, negu savojo. Todėl natrio elektronas atitenka chlorui, susidaro joninis ryšys.
Sieros ir chloro branduolių krūvis skiriasi tik vienetu, tad ir elektronų trauka, ir atomų dydis yra panašūs. Todėl nė vienas iš atomų negali atimti elektronų. Tarp sieros ir chloro susidaro kovalentinis ryšys.
Dar kartą atkreipkite dėmesį, kad lyginome vienodą elektronų sluoksnių skaičių turinčių atomų branduolių krūvius. Jeigu sluoksnių skaičius skirtingas, traukos jėgas įvertinti sudėtingiau. Atomų gebą traukti elektronus rodo elektrinis neigiamumas. Kuo didesnis susijungiančių atomų elektrinio neigiamumo skirtumas, tuo didesnė tikimybė susidaryti joniniam ryšiui. Deja, vien iš elektrinio neigiamumo skirtumo vienareikšmiškai nustatyti ryšio tipo nepavyks. Reikia atsižvelgti, iš kokių elementų – metalų ar nemetalų – susidaro junginys, kokios to junginio savybės (žr. 3.2 lentelę).
Joniniai ryšiai susidaro:
- iš dviejų elementų sudarytuose junginiuose, kai vienas elementas yra metalas, o kitas nemetalas (pvz., CaO, CaH2, CaCl2);
- druskose, net jei jų sudėtyje nėra metalo (pvz., Ca(NO3)2, NH4NO3, (NH4)2SO4);
- metalų hidroksiduose (pvz., KOH, Ba(OH)2).
Kitais atvejais susidaro kovalentiniai ryšiai.
1 pavyzdys
Nurodykite, kokie cheminiai ryšiai yra vandenilio fluorido HF ir magnio bromido MgBr2 junginiuose. Šių junginių fizikinės savybės pateiktos 3.3 lentelėje.
3.3 lentelė. Dviejų junginių savybės
Junginys | Elektrinio neigiamumo skirtumas | Lydymosi temperatūra | Virimo temperatūra | Vandeninio tirpalo laidumas elektros srovei |
Vandenilio fluoridas HF | 1,8 | –84 °C | 20 °C | Mažai laidus |
Magnio bromidas MgBr2 | 1,7 | 711 °C | 1250 °C | Laidus |
Sprendimas
Vandenilio ir fluoro ar magnio ir bromo elektrinio neigiamumo skirtumas panašus. Didžiulis HF ir MgBr2 lydymosi ir virimo temperatūros skirtumas aiškiai rodo, kad cheminiai ryšiai šiose medžiagose skirtingi. Aukšta lydymosi ir virimo temperatūra būdinga nemolekulinės sandaros kovalentiniams ir joniniams junginiams. Pirmąjį variantą galima atmesti todėl, kad MgBr2 vandeninis tirpalas laidus elektros srovei. Be to, nemolekulinės sandaros kovalentiniai junginiai apskritai netirpūs vandenyje. Tad magnio bromidas yra joninis junginys. Žema HF lydymosi ir virimo temperatūra rodo, kad ši medžiaga sudaryta iš molekulių, tad ryšiai joje kovalentiniai. HF tirpalas šiek tiek laidus elektros srovei, nes dėl sąveikos su vandeniu nedidelė dalis molekulių virsta jonais, HF yra rūgštinių savybių medžiaga.
Atsakymas: HF junginyje yra kovalentiniai, o MgBr2 junginyje – joniniai ryšiai.
Klausimai ir užduotys
- Jeigu nors dalis cheminių ryšių yra joniniai, medžiaga priskiriama prie joninių junginių. Kurios šių medžiagų yra joninės, o kurios kovalentinės?
- SO3(d);
- MgCl2(k);
- CH3CH2CH2CH2OH(s);
- NH3(d);
- HCl(d);
- MgSO4(k);
- CuSO4 · 5H2O(k);
- Br2(s).
- Kurios medžiagos lydymosi temperatūra aukštesnė? Paaiškinkite, kaip tai nustatėte.
- KBr ar CH3CH2OH;
- SO2 ar CaO;
- NO2 ar NaNO3.
- Ar teisingas teiginys „Visos medžiagos sudarytos iš molekulių“? Pagrįskite arba paneikite šį teiginį.
- Silicio karbidas SiC yra trapi, labai kieta medžiaga. Kietumu nusileidžia tik deimantui. Jos lydymosi temperatūra beveik 3000 °C. Ką apie šios medžiagos sandarą galima pasakyti remiantis išvardytomis savybėmis?
- Didelius valgomosios druskos kristalus išauginti sunku. Dažniausiai susidaro daug smulkių kubo formos kristalų. Mokinys užaugino kubo formos natrio chlorido kristalą, kurio briaunos ilgis – tik 0,50 mm. Šio kristalo masė 0,27 mg. Apskaičiuokite:
- natrio chlorido kristalo tankį;
- natrio jonų skaičių šiame kristale.

