Dònoras, akcèptorius, koordinãcinis ryšỹs, bendróji chèminė lygtis, sutrumpintoji jòninė lygtis, bendróji elektrònų porà, laisvòji elektrònų porà.
Koordinacinis (donorinis-akceptorinis) ryšys
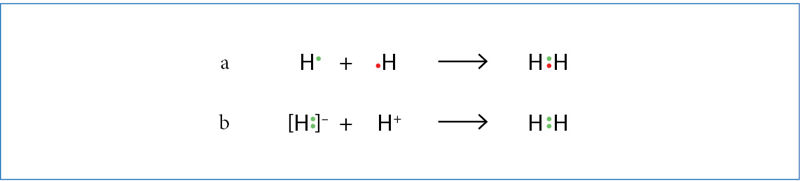
Paprastai kovalentinis ryšys susidaro, kai susijungia po vieną elektroną turinčios dviejų atomų orbitalės (3.5.1 pav., a). Bendroji elektronų pora gali susidaryti ir kitu būdu (3.5.1 pav., b). Antruoju atveju H– jonas yra dònoras (davėjas, duoda elektronų porą), H+ jonas – akcèptorius (gavėjas, ryšiui sudaryti pasinaudoja kitos dalelės elektronais, pats duoda tik tuščią orbitalę). Nors abiem atvejais susidaro toks pat kovalentinis ryšys, donoriniu-akceptoriniu būdu susidariusiam kovalentiniam ryšiui prigijo koordinãcinio ryšio pavadinimas. Tokiam ryšiui susidaryti reikia, kad viena dalelė turėtų laisvąją elektronų porą, o kita – tuščią orbitalę.
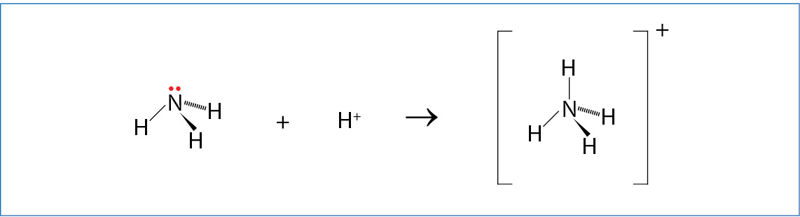
Amonio jono susidarymas
Amoniakas NH3 yra bazinių savybių medžiaga. Reaguojant su rūgštimis susidaro amonio jonas . Bendróji ir sutrumpintoji jòninė lygtis:
NH3(aq) + HNO3(aq) → NH4NO3(aq);
(3.5.1)
NH3(aq) + H+(aq) →
(3.5.2)
3.5.2 paveiksle parodytas amonio jono susidarymas.
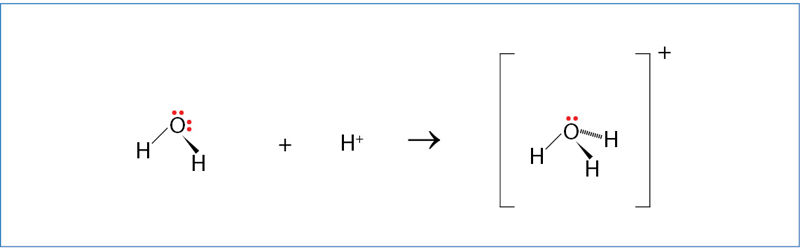
Oksonio jono susidarymas
Tai, ką lygtyse žymime kaip vandenilio joną H+(aq), yra šiek tiek sudėtingesnė dalelė. Vandeniniame tirpale H+ jonas jungiasi su vandens molekule ir sudaro oksonio joną H3O+. Šis jonas susidaro koordinaciniu būdu (3.5.3 pav.).
Klausimai ir užduotys
- Apibūdinkite cheminius ryšius amoniako molekulėje pagal poliškumą ir orbitalių jungimosi būdą. Ar visi cheminiai ryšiai amoniako molekulėje yra vienodi?
- Apibūdinkite cheminius ryšius amonio jone pagal poliškumą ir orbitalių jungimosi būdą. Ar visi cheminiai ryšiai amonio jone yra vienodi?
- Visos deguonies orbitalės oksonio jone yra vienodos. Kokio tipo deguonies hibridizacija yra oksonio jone?
- Boras yra antrojo periodo 13 (IIIA) grupės elementas.
- Kiek orbitalių yra boro atomo valentiniame sluoksnyje? Ar visos jo valentinio sluoksnio orbitalės užimtos elektronais?
- Su fluoru boras sudaro junginį BF3. Luiso formule parodykite BF3 molekulės susidarymą iš boro ir fluoro atomų. Ar šioje molekulėje boro valentiniame sluoksnyje yra elektronų oktetas (aštuonių elektronų rinkinys)?
- Galima tokia reakcija: F– + BF3 →
BF 4 -
