Metališkasis ryšys
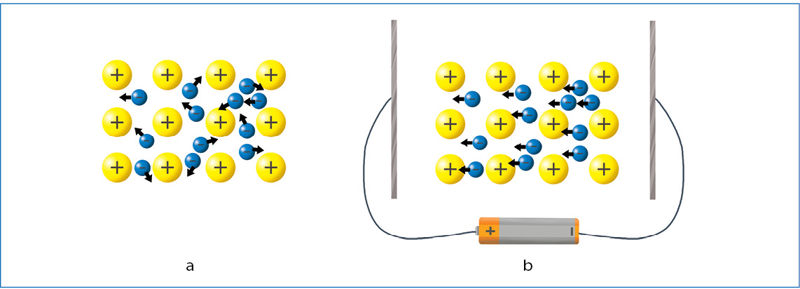
Metalų elektrinis neigiamumas mažas, t. y. jie silpnai traukia tiek savo valentinius, tiek kitų atomų elektronus. Todėl metalų valentiniai elektronai nepriklauso kuriam nors konkrečiam atomui. Jie yra bendri visam metalo mėginiui ir jame juda laisvai. Tai vadinama metãliškuoju ryšiù. Populiarus metalų sandaros aiškinimo vaizdinys yra toks. Metalo jonai sudaro tvarkingą kristalą, o tarp šių jonų chaotiškai juda valentiniai elektronai. Laisvai judantys elektronai sudaro „elektronų jūrą“, kurioje „skendi“ teigiamieji metalo jonai (3.6.1 pav., a).
Metalų fizikinės savybės
Elektros laidai ir mikroschemų jungtys gaminami iš metalų (3.6.2 pav.), nes šie yra elektros srovės laidininkai. Jeigu prie metalinio strypo galų prijungsime bateriją, laisvieji elektronai pradės judėti kryptingai, teigiamojo baterijos poliaus link (3.6.1 pav., b).


Metalai yra kalūs ir tąsūs. Iš jų galima išploti plonus lakštus arba ištempti vielą (3.6.3 pav.). Žinoma, dauguma metalų gana tvirti. Norint juos išploti ar ištempti reikia pakankamos jėgos. Kai sakoma, kad jie yra kalūs ir tąsūs, turima omenyje, jog jie kalami ar tempiami nesutrupa (kaip, pavyzdžiui, joniniai kristalai). Metališkasis ryšys apima visą metalo mėginį. Jame nėra kryptingų ryšių. Metalo jonai laikosi drauge ne todėl, kad jie traukia vienas kitą, o todėl, kad juos traukia judri neigiamoji „elektronų jūra“. Deformavus metalą (sulenkus, suplojus, ištempus), teigiamųjų jonų sluoksniai pasislenka, o laisvai judantys elektronai greitai persiskirsto ir prisiderina prie naujo teigiamųjų krūvių išsidėstymo. Įvairios priemaišos gali trukdyti metalų katijonų sluoksniams pasislinkti, todėl daugelis lydinių yra tvirtesni už grynus metalus. Pavyzdžiui, iš grynos geležies pagamintas peilis greitai atšiptų, o geležies ir nedidelio kiekio (iki 1,5 %) anglies lydinys – plienas – yra daug tvirtesnis ir tinkamesnis įrankiams gaminti (3.6.4 pav.).

Metalai yra geri šilumos laidininkai. Jeigu kaitinsime vieną metalinio strypo galą, gana greitai įkais ir kitas. Tai irgi susiję su laisvu elektronų judėjimu. Jie perneša energiją metale.
Metalai blizga. Tai lemia laisvųjų elektronų ir šviesos fotonų sąveikos ypatumai. Metalai atspindi bet kurio bangos ilgio šviesą. Tik nedaugelis metalų dalį šviesos sugeria ir įgyja spalvą (pavyzdžiui, auksas). Dalies metalų paviršius oksiduojasi ir praranda blizgesį (pavyzdžiui, anksčiau naudotos aliumininės lietuviškų 1, 2 ir 5 centų monetos). Aštriu įrankiu įbrėžkite tokį metalą ir pamatysite, kad įbrėžimo vietoje jis yra blizgus. Tad neblizgus yra ne pats metalas, o jo oksido ar kitų paviršiuje susidariusių junginių sluoksnis. Dėl blizgumo metalai naudojami veidrodžių gamybai. Senoviniams veidrodžiams buvo naudojamas sidabras. Vėliau jį pakeitė pigesnis aliuminis. Lygus, poliruotas stiklas padengiamas plonu aliuminio sluoksniu. Stiklas apsaugo aliuminį nuo oksidacijos, todėl blizgesys nedingsta.
Metalo lydymosi temperatūra daugiausia priklauso nuo valentinių elektronų skaičiaus ir metalo atomo spindulio. Metalo jonus „suklijuoja“ laisvieji elektronai. Tad daugiau valentinių elektronų turintys metalai paprastai yra kietesni ir lydosi aukštesnėje temperatūroje. Esant didesniam atomo spinduliui, lydymosi temperatūra žemesnė, nes padidėja atstumas tarp atomo branduolio ir laisvųjų elektronų. Pavyzdžiui, mažiausias iš šarminių metalų yra ličio atomas. Litis lydosi 180 °C temperatūroje, o gerokai didesnius atomus turinčiam ceziui išlydyti pakanka 28 °C. Žemiausia lydymosi temperatūra yra gyvsidabrio. Jis lydosi –39 °C temperatūroje, tad įprastomis sąlygomis yra skystas. Aukščiausia lydymosi temperatūra volframo – net 3422 °C.
Klausimai ir užduotys
- Cheminis ryšys – tai trauka tarp vienokių ar kitokių dalelių. Tarp ko pasireiškia trauka esant metališkajam ryšiui?
- Jonų
- Neutraliųjų atomų
- Metalo jonų ir laisvųjų elektronų
- Elektronų
- Paaiškinkite, kodėl metalai yra laidūs elektros srovei.
- Natris ir magnis yra to paties periodo metalai. Natris išsilydo 98 °C, o magnis – 649 °C temperatūroje. Paaiškinkite, kodėl magnio lydymosi temperatūra aukštesnė už natrio.
- Natris ir cezis yra tos pačios grupės metalai. Natris išsilydo 98 °C temperatūroje, o cezis – 28 °C. Paaiškinkite, kodėl cezio lydymosi temperatūra žemesnė už natrio.
- Auksas – plastiškiausias iš visų metalų. Sakoma, kad iš 1,0 g aukso galima ištempti 2,0 km ilgio vielą. Apskaičiuokite, koks yra tokios vielos storis. Viela yra ritinio formos kūnas. Aukso tankis 19,3 g/cm3.

