Šarminiai metãlai, šarminių žẽmių metãlai, oksidãcijos-redùkcijos reãkcija, amoniãkas, vandenilio halogenidai, druskà.
Dvinariai junginiai su vandeniliu
Išnagrinėjome oksidų savybių periodiškumą. Kita svarbi dvinarių junginių klasė – junginiai su vandeniliu. Šarminiai ir šarminių žemių metalai (1 ir 2 grupės metalai, išskyrus berilį) sudaro bazinių savybių hidridus. Šiems reaguojant su vandeniu ir rūgštimis, vyksta oksidacijos-redukcijos reakcija – keičiasi vandenilio oksidacijos laipsnis:
NaH + H2O → NaOH + H2;
(4.5.1)
CaH2 + 2H2O → Ca(OH)2 + 2H2;
(4.5.2)
2NaH + H2SO4 → Na2SO4 + 2H2;
(4.5.3)
CaH2 + H2SO4 → CaSO4 + 2H2.
(4.5.4)
Nemetalų junginiai su vandeniliu
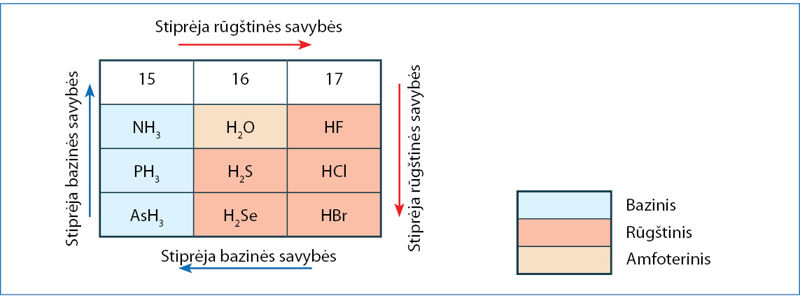
13 ir 14 grupės nemetalai su vandeniliu sudaro neutraliuosius (nepasižyminčius nei bazinėmis, nei rūgštinėmis savybėmis) junginius, pavyzdžiui, B2H6, CH4, SiH4. 15 grupės elementai sudaro bazinius junginius (4.5.1 pav.). Svarbiausias jų – amoniakas NH3. Ši medžiaga priskiriama silpnosioms bazėms. Kaip ir visos bazinės medžiagos, amoniakas reaguoja su rūgštimis:
NH3 + HNO3 → NH4NO3.
(4.5.5)
Vykstant šiai reakcijai susidariusi druska vadinama amonio nitratu. Ji sudaryta iš amonio ir nitrato jonų. Nors šioje druskoje nėra metalo, tai – joninis junginys.
16 grupės elementų vandeniliniai junginiai yra silpnų rūgštinių savybių. Tik vanduo priskirtinas prie amfoterinių, nes nedidelė dalis vandens molekulių sudaro ir rūgštims būdingus H+ jonus, ir bazinius OH– jonus. 17 grupės junginys HF yra silpna rūgštis, HCl, HBr ir HI yra stiprių rūgštinių savybių medžiagos.
Atkreipkite dėmesį, kad grupėse elementų deguoninių ir vandenilinių dvinarių junginių rūgštinės ir bazinės savybės kinta priešinga seka. Pavyzdžiui, iš 16 grupės oksidų stipriausios rūgštinės savybės yra sieros(VI) oksido SO3, o iš vandenilinių junginių šioje grupėje stipriausias rūgštines savybes turi vandenilio telūridas H2Te.
Pavadinimai su priesagomis -at-, -it-, -id-
Junginių pavadinimuose vartojamos priesagos, susijusios su elemento oksidacijos laipsniu. Aptarėme tris elementų būdingiausių oksidacijos laipsnių taisykles (žr. 4.3 temos skirsnį Pagrindinių grupių elementų oksidacijos laipsniai). Išnagrinėkite 4.5 lentelę ir išsiaiškinkite, kaip šios taisyklės susijusios su 14–16 grupių elementų rūgščių ir druskų pavadinimais.
17-osios grupės elementams chlorui, bromui ir jodui būdingi dar du papildomi oksidacijos laipsniai, todėl, be priesagų -at- ir -it-, vartojami priešdėliai per- ir hipo- (žr. 4.6 lentelę).
4.5 lentelė. 14–16 grupių elementų junginių pavadinimai
Oksidacijos laipsnis | Vartojama priesaga | Grupės numeris ir pavadinimų pavyzdžiai |
Didžiausias, lygus valentinių elektronų skaičiui | -at- | 14 grupė: 15 grupė: H3P+5O4 fosfato rūgštis, 16 grupė: |
Dviem vienetais mažesnis už didžiausią | -it- | 15 grupė: 16 grupė: |
Aštuoniais vienetais mažesnis už didžiausią | -id- | 16 grupė: |
4.6 lentelė. 17 grupės elementų junginių pavadinimai
Oksidacijos laipsnis | Vartojamas priešdėlis ar priesaga | Pavadinimų pavyzdžiai |
Didžiausias, lygus valentinių elektronų skaičiui | per- | HCl+7O4 perchlorato rūgštis, |
Dviem vienetais mažesnis už didžiausią | -at- | HCl+5O3 chlorato rūgštis, |
Keturiais vienetais mažesnis už didžiausią | -it- | HCl+3O2 chlorito rūgštis, |
Šešiais vienetais mažesnis už didžiausią | hipo- | HCl+1O hipochlorito rūgštis, |
Aštuoniais vienetais mažesnis už didžiausi | -id- | HCl–1 vandenilio chloridas, vandenilio chlorido rūgštis, |
Klausimai ir užduotys
- Parašykite lygtį reakcijos, kuri vyksta vandeniu veikiant:
- KH;
- BaH2.
- Kurie šių junginių pasižymi rūgštinėmis savybėmis?
- SrH2
- HF
- H2Se
- PH3
- CH4
- Parašykite junginio pavadinimą:
- Ca(NO3)2;
- NH4Cl;
- Ba(ClO4)2;
- NaClO3.
