Rūgštinis oksidas, bãzinis oksidas, amfotèrinis oksidas, neutralùsis oksidas, oksidãcijos láipsnis.
Išskyrus helį, neoną ir argoną, visi kiti elementai sudaro dvinarius junginius su deguonimi – oksidus. Oksidai skirstomi į rūgštiniùs, bãzinius, amfotèrinius ir neutraliúosius.
Nemetalų oksidai
Dauguma nemetalų oksidų yra rūgštiniai.
- Rūgštiniai oksidai reaguoja su baziniais oksidais ir hidroksidais, sudarydami druskas. Pavyzdžiui, rūgštinis oksidas SO3 reaguoja taip:
SO3 + Na2O → Na2SO4;
(4.4.1)
SO3 + 2NaOH → Na2SO4+ H2O;
(4.4.2a)
SO3 + NaOH → NaHSO4.
(4.4.2b)
- Dauguma rūgštinių oksidų reaguoja su vandeniu, sudarydami rūgštis, pavyzdžiui:
SO3 + H2O → H2SO4;
(4.4.3)
N2O5 + H2O → 2HNO3.
(4.4.4)
Neutralieji oksidai – CO, N2O, NO – nereaguoja nei su vandeniu, nei su rūgštinėmis ar bazinėmis medžiagomis.
Oksido pavadinimas
Vartojama dvejopa oksidų pavadinimų sudarymo sistema. N2O5 galima pavadinti diazoto pentoksidu (t. y. nurodant indeksus) arba azoto(V) oksidu (t. y. nurodant elemento oksidacijos laipsnį). Dalis metalų būna tik vieno oksidacijos laipsnio (1 ir 2 grupės metalai, taip pat aliuminis). Šių metalų oksidų pavadinimuose oksidacijos laipsnis nenurodomas. Pavyzdžiui, BaO vadinamas tiesiog bario oksidu.
Metalų oksidai
Dauguma metalų oksidų yra baziniai.
- Baziniai oksidai reaguoja su rūgštimis ir rūgštiniais oksidais, sudarydami druskas, pavyzdžiui, kalcio oksidas:
CaO + CO2 → CaCO3;
(4.4.5)
CaO + 2HNO3 → Ca(NO3)2 + H2O.
(4.4.6)
- Baziniai 1-osios ir iš dalies 2-osios grupės metalų oksidai reaguoja su vandeniu, sudarydami hidroksidus:
CaO + H2O → Ca(OH)2.
(4.4.7)
Dalis metalų oksidų, pavyzdžiui, aliuminio, cinko, yra amfoteriniai – reaguoja ir su rūgštimis, ir su bazėmis. Pavyzdžiui, aliuminio oksidas:
Al2O3 + 6HCl → 2AlCl3 + 3H2O;
(4.4.8)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4].
(4.4.9)
Junginys Na[Al(OH)4] vadinamas natrio tetrahidroksialiuminatu.
Pereinamųjų metalų oksidų savybės gerokai sudėtingesnės. Pavyzdžiui, CrO yra bazinis, Cr2O3 amfoterinis, o CrO3 – rūgštinis oksidas. Didėjant pereinamojo elemento oksidacijos laipsniui, jo oksidų rūgštinės savybės stiprėja, o bazinės silpnėja.
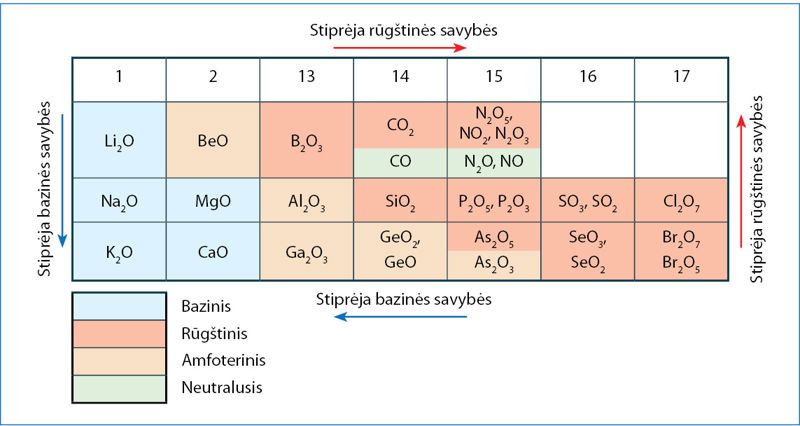
Rūgštinių ir bazinių savybių kitimas
Išnagrinėję 4.4.1 paveikslą matote, kad oksidų rūgštinės savybės perioduose stiprėja iš kairės į dešinę, o grupėse – iš apačios į viršų. Bazinių savybių kitimo kryptys atvirkščios rūgštinėms. Tarp išreikštų bazinių ir rūgštinių savybių oksidų įsiterpia amfoteriniai oksidai, turintys ir silpnų rūgštinių, ir silpnų bazinių savybių.
Ką turime omenyje, kai sakome, jog rūgštinės savybės stiprėja? Panagrinėkime trečiojo periodo nemetalų oksidų savybes.
Chloro(VII) oksidas Cl2O7 reaguoja su vandeniu, sudarydamas labai stiprią perchlorato rūgštį, o su natrio hidroksidu – druską:
Cl2O7 + H2O → 2HClO4;
(4.4.10)
Cl2O7 + 2NaOH → 2NaClO4 + H2O.
(4.4.11)
Jungdamasis su vandeniu, sieros(VI) oksidas sudaro stiprią sulfato rūgštį H2SO4 (žr. (4.4.3) lygtį), o su NaOH – druską (žr. 4.4.2) lygtį).
Reaguodamas su vandeniu, fosforo(V) oksidas sudaro silpną fosfato rūgštį, o su NaOH – druską:
P2O5 + 3H2O → 2H3PO4;
(4.4.12)
P2O5 + 6NaOH → 2Na3PO4 + 3H2O;
(4.4.13a)
P2O5 + 4NaOH → 2Na2HPO4 + H2O;
(4.4.13b)
P2O5 + 2NaOH +H2O → 2NaH2PO4.
(4.4.13c)
Silicio(IV) oksidas SiO2 (pagrindinė smėlio sudedamoji dalis) su vandeniu net nereaguoja, tačiau reaguoja su stipriomis bazėmis, pavyzdžiui, NaOH. Labai silpna silicio rūgštis susidaro iš druskos:
SiO2+ 2NaOH → Na2SiO3+ H2O;
(4.4.14)
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl.
(4.4.15)
To paties elemento oksido rūgštinės savybės tuo stipresnės, kuo didesnis elemento oksidacijos laipsnis. Pavyzdžiui, SO3 sudaro stipriąją sulfato rūgštį H2SO4, o SO2 – silpnąją sulfito rūgštį H2SO3.
Klausimai ir užduotys
- Išvardykite keturias oksidų klases ir nurodykite, kas kiekvienai jų būdinga.
- Parinkite tinkamus žodžius.
Dauguma nemetalų oksidų būna ................. (rūgštiniai / baziniai). Jie reaguoja su ................. (rūgštinių / bazinių) savybių medžiagomis, o tie, kurie reaguoja su vandeniu, sudaro ................. (rūgštis / hidroksidus). Dalis nemetalų oksidų būna ................. (neutralieji / amfoteriniai).
- Kurio oksido rūgštinės savybės stipresnės:
- SeO2 ar SeO3;
- CO ar CO2;
- N2O3 ar N2O5?
- Parašykite reakcijų lygtis, kuriomis būtų parodyta, kaip su vandeniu reaguoja nurodyti oksidai:
- SeO3;
- SeO2;
- CO2;
- N2O3;
- SrO;
- K2O.
Parašykite susidarančio junginio pavadinimą.
- Aliuminio ir cinko oksidai (Al2O3 ir ZnO) yra amfoteriniai. Parašykite šių oksidų reakcijų su druskos rūgšties ir kalio hidroksido tirpalais bendrąsias ir sutrumpintąsias jonines lygtis. Reaguojant su hidroksido tirpalu susidaro tetrahidroksialiuminato ir tetrahidroksicinkato jonai.
- Aliuminio ir cinko hidroksidai (Al(OH)3 ir Zn(OH)2) yra amfoteriniai. Parašykite šių hidroksidų reakcijų su druskos rūgšties ir kalio hidroksido tirpalais bendrąsias ir sutrumpintąsias jonines lygtis.
- Fosforo(V) oksidui reaguojant su kalio hidroksido tirpalu, gali susidaryti skirtingos druskos (žr. (4.4.13 a, b, c) lygtis). Nurodykite, nuo ko priklauso, kuri druska susidarys.
- Į 0,120 kg vandens įdėjus 0,020 kg bario oksido, susidarė tirpalas, kurio tankis 1,09 g/cm3. Nurodykite, kokios medžiagos tirpalas susidarė, ir apskaičiuokite šios medžiagos koncentraciją:
- procentinę;
- masės;
- molinę.

