Skyriaus santrauka
- Atomo gebėjimas pritraukti kitų atomų elektronus vadinamas elektriniu neigiamumu.
- Kuo didesnis atomo elektrinis neigiamumas, tuo šis atomas labiau pritraukia elektronus.
- Atomas gali prisijungti ar atiduoti tiek elektronų, kad jo išorinis sluoksnis taptų panašus į inertinių dujų išorinį elektronų sluoksnį.
- Cheminiu ryšiu vadinama sąveika, atsiradusi tarp dalelių, kurios jungiasi tarpusavyje ir sudaro junginį.
- Kai elementų elektrinio neigiamumo skirtumas yra > 1,8, susidaro joninis ryšys; jei šis skirtumas yra nuo 0,4 iki 1,8, ryšys yra kovalentinis polinis; jei elektrinio neigiamumo skirtumas < 0,4, cheminis ryšys yra kovalentinis nepolinis.
- Elektronų sluoksnyje elektronai stengiasi būti poromis. Jei poros negali susidaryti, elektronai lieka nesuporuoti.
- Jungdamiesi kovalentiniu ryšiu elementai sudaro bendras elektronų poras – tai energiškai naudinga.
- Joninis ryšys susidaro atomams atiduodant ir prisijungiant elektronus.
- Tarpmolekuliniai ryšiai susidaro tarp atskirų molekulių ir yra silpnesni už kovalentinius ar joninius ryšius. Tarpmolekuliniai ryšiai labai svarbūs palaikant sudėtingų ir didelių molekulių sandarą.
- Susidarant kovalentiniam poliniam ryšiui, bendra elektronų pora pasislenka arčiau atomo, kurio elektrinis neigiamumas didesnis.
- Atomai, susijungę kovalentiniu nepoliniu ryšiu, bendra elektronų pora dalijasi vienodai.
- Joniniai junginiai yra kietosios medžiagos, jiems būdinga kristalinė sandara ir aukšta lydymosi temperatūra.
- Tirpstant joniniam junginiui, vandens molekulės atskiria jonus ir apsupa juos.
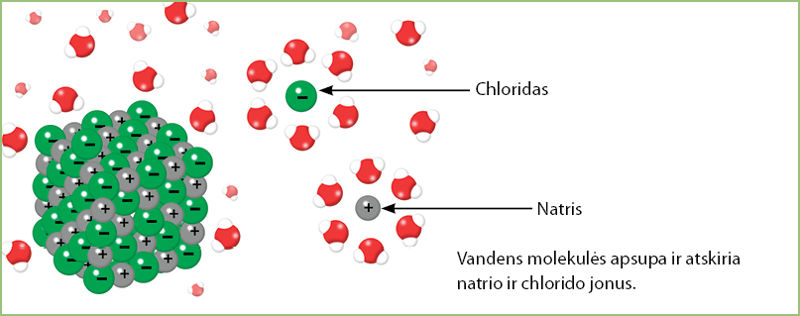
- Kovalentiniai junginiai sudaro atskiras molekules. Jie gali būti dujinės, skystosios arba kietosios būsenos.
- Cheminė formulė išreiškiama elementų simboliais ir indeksais.
- Junginio chemine formule rodoma, kokie elementai sudaro junginį ir kokiu santykiu jie jungiasi.
- Perioduose atomų spindulys mažėja iš kairės į dešinę.
- Vieninėmis vadinamos medžiagos, sudarytos iš to paties cheminio elemento atomų. Tarp šių atomų yra kovalentiniai nepoliniai ryšiai.
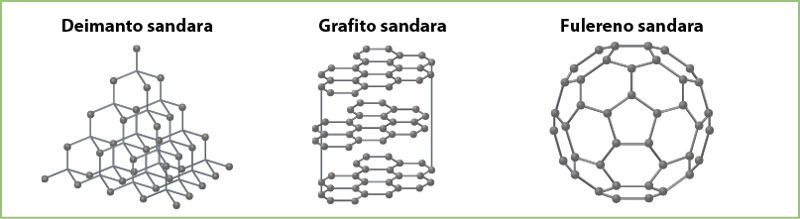
- Vieninės medžiagos, kurios skiriasi savo sandara ir savybėmis, vadinamos alotropinėmis atmainomis. Pavyzdys – anglies alotropinės atmainos: grafitas, deimantas, fulerenas.
- Atominiu masės vienetu vadinamas dydis, lygus
$\frac{1}{12}$112 anglies izotopo 12C masės. - Norint apskaičiuoti junginio santykinę molekulinę masę, reikia sudėti šio junginio elementų santykines atomines mases.
- Siekiant apskaičiuoti elemento masės dalį junginyje, reikia šio elemento santykinę atominę masę padalyti iš junginio santykinės molekulinės masės:
Procentinė masės dalis nustatoma gautą rezultatą dauginant iš 100 %.
Pasitikrinu ir įsivertinu
- Pavaizduokite ličio ir deguonies junginio susidarymą, nupiešdami jų atomų išorinius elektronų sluoksnius ir šių sluoksnių pokyčius po susijungimo. Parašykite, į kurias inertines dujas pagal elektronų išsidėstymą išoriniame sluoksnyje taps panašūs susidarę jonai.
- Fosforas sudaro junginį su deguonimi. Kurio iš šių elementų elektrinis neigiamumas yra didesnis? Ar šie elementai, susijungę tarpusavyje, sudarys joninį junginį? Kiek išorinio sluoksnio elektronų gali pereiti iš vieno elemento kitam?
- Kuris šių teiginių yra tikslus?
- Magnio atomas turi mažiau elektronų negu Mg2+ jonas.
- Magnio atomas turi daugiau protonų negu Mg2+ jonas.
- Magnio atomas turi daugiau elektronų negu Mg2+ jonas.
- Magnio atomas ir Mg2+ jonas turi vienodą protonų ir elektronų skaičių.
- Koks cheminis ryšys susidarys tarp šių elementų?
- Li ir Cl;
- S ir Cl;
- C ir F;
- H ir C.
- Tarp kurių iš šių junginių molekulių susidarys vandenilinis ryšys (galimi keli atsakymai)?
- HCl
- CH4
- H2
- NH3
- Kuris iš nurodytų ryšių yra labiau polinis?
- N–F
- C–F
- H–F
- O–F
- Parašykite sieros trioksido junginio formulę. Apskaičiuokite šio junginio santykinę molekulinę masę.
- Taškinėmis formulėmis pavaizduokite šių medžiagų formules:
- NH3
- H2
- BF3
- ClO2.
- Apskaičiuokite CCl4 junginio santykinę molekulinę masę.
- Nustatykite, koks junginio XO2 elementas pažymėtas simboliu X, jei jo santykinė molekulinė masė yra 46.
- C
- N
- Cl
- B
Apskaičiuokite procentinę elemento X dalį šiame junginyje.
- Kokia yra aukso(III) oksido Au2O3 santykinė molekulinė masė?
- 213
- 245
- 410
- 442
- Apskaičiuokite vario(I) oksido Cu2O santykinę molekulinę masę.
- Apskaičiuokite, kiek kartų anglies dioksido santykinė molekulinė masė yra didesnė už helio dujų santykinę molekulinę masę.
- Azotas su deguonimi gali sudaryti kelis oksidus. Apskaičiuokite toliau pateiktų junginių santykinę molekulinę masę ir nurodykite, kurio oksido santykinė molekulinė masė yra didžiausia:
- N2O;
- NO;
- NO2.
- Apskaičiuokite geležies masės dalį geležies rūdoje, kurios formulė yra Fe3O4.

