Vykstant cheminiams medžiagos kitimams – cheminėms reakcijoms – susidaro naujų, kitokios sudėties, sandaros, savybių medžiagų. Šiame skyriuje aptarsime cheminių reakcijų įvairovę, stebėsime jų eigą, sužinosime, kaip chemines reakcijas išreikšti lygtimis.
Cheminių reakcijų požymiai
Ankstesnėse klasėse sužinojote, kad medžiagos kinta. Vykstant fizikiniams medžiagų kitimams, pakinta tik medžiagos agregatinė būsena: kietosios medžiagos virsta skystosiomis, šios – dujinėmis. Vykstant cheminiams medžiagų kitimams – cheminėms reakcijoms – susidaro naujų medžiagų (4.1.1–4.1.3 pav.).
Chèminėmis reãkcijomis vadiname kitimus, kuriems vykstant susidaro naujų – kitos sudėties, sandaros ir savybių – medžiagų.
Jūsų mokytojas arba jūs patys prižiūrimi mokytojo galite atlikti tyrimą. Stebėkite vyksiančius medžiagos kitimus ir cheminės reakcijos požymius. Nepamirškite apsauginių akinių!
Tyrimas
Magnio arba aliuminio folijos juostelės deginimas ore
Darbo tikslas: stebėti metalinio magnio arba aliuminio sąveiką su ore esančiu deguonimi.
Jums reikės:
- metalinio magnio arba aliuminio folijos juostelės;
- degiklio;
- laboratorinių žnyplių arba metalinio pinceto;
- degtukų (jei reikia).
Darbo eiga:
- Uždekite degiklį.
- Metalinėmis žnyplėmis arba pincetu suimkite magnio arba aliuminio folijos juostelę.
- Palaikykite šią juostelę virš degiklio liepsnos (4.1.4 pav.).
- Stebėkite sąveikos požymius.
- Baigę eksperimentą apžiūrėkite rezultatą.

Paaiškinimas. Tikriausiai pastebėjote šiuos cheminės reakcijos požymius: veikiama liepsnos, magnio ar aliuminio folijos juostelė užsidegė; liepsna tapo ryškesnė; pasklido dūmai. Įvykus reakcijai iš juostelės susidarė baltos spalvos byranti medžiaga, panaši į pelenus. Tai – reakcijos produktas.
Kaip matome iš įvykusios cheminės reakcijos, viena medžiaga virto kita, visai kitos sudėties, medžiaga. Ši nauja susidariusi baltos spalvos medžiaga vadinama magnio oksidu – tai magnio ir deguonies junginys.
Cheminių reakcijų požymiai: spalvos, temperatūros pokytis, liepsnos atsiradimas, dujų išsiskyrimas, nuosėdų susidarymas tirpaluose.
Cheminių reakcijų lygtys
Norint parodyti, kas nutinka, vykstant cheminei reakcijai, užrašoma chèminė lygtis.
Parašykime žodinę magnio ir deguonies reakcijos lygtį:
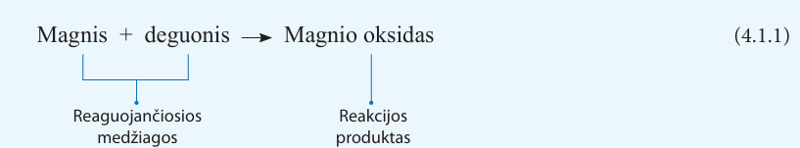
Magnis ir deguonis yra reagúojančiosios medžiagos, arba kitaip – reageñtai. Magnio ir deguonies junginys – magnio oksidas – reãkcijos prodùktas. Kodėl šis junginys vadinamas oksidu? Kaip pamenate, visi elementų junginiai su deguonimi yra vadinami oksidais. Neigiamasis jonas, susidaręs iš deguonies, vadinamas oksido jonu.
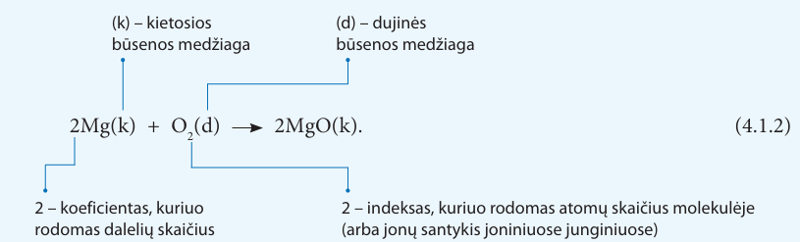
Šią lygtį galime užrašyti cheminiais simboliais. Prisiminkime, kad deguonis yra sudarytas iš dviatomių molekulių (žr. 3.7.1 lentelę). Žinome, kad dviem deguonies molekulės atomams reikia dviejų magnio atomų (taip deguonis ir magnis pasieks užpildytus elektronų sluoksnius). Gauname tokią lygtį:
Medžiagų agregatinė būsena cheminių reakcijų lygtyse žymima taip:
- k – kietoji medžiaga;
- s – skystis;
- d – dujos;
- aq – vandenyje ištirpusi medžiaga
Ką rodo koeficientai prieš medžiagų chemines formules? Jie rodo medžiagos dalelių (molekulių, jonų) skaičių prieš reakciją (kairiojoje lygties pusėje) ir reakcijai pasibaigus (dešiniojoje lygties pusėje). Kaip matote iš reakcijos lygties, kiekvieno elemento dalelių skaičius prieš reakciją ir po jos išlieka toks pats. Pavyzdžiui, deguonies molekulę sudaro du deguonies atomai – tai rodo deguonies atomo indeksas (O2). Su dviem deguonies atomais susijungia 2 magnio atomai, todėl kairiojoje lygties pusėje prieš magnio simbolį rašomas koeficientas 2. Po reakcijos gautame junginyje 2MgO koeficientas 2 rodo, kad susidarė dvi magnio ir dvideguonies dalelės – jonai.
Kiekvieno elemento dalelių skaičius prieš reakciją ir po jos turi būti lygus.
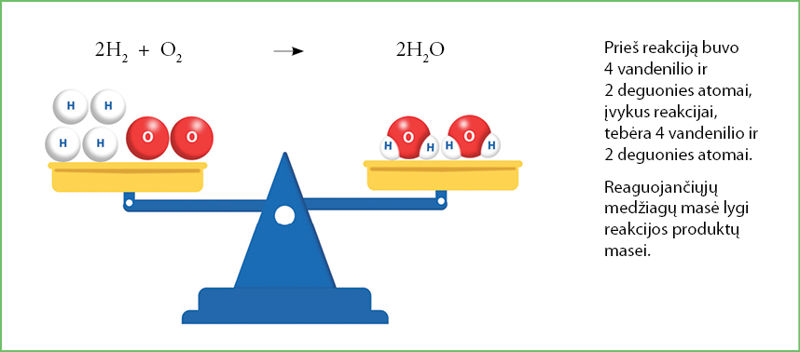
Vykstant cheminei reakcijai atomai, net kaitinami ar deginami, nėra suardomi, todėl pasibaigus reakcijai atomų lieka tiek pat, kiek jų buvo prasidedant reakcijai (4.1.5 pav.). Vadinasi, reakcijos produktų masė lygi reaguojančiųjų medžiagų masei. Tai medžiagų mãsės tvermės dėsnis. Šį dėsnį 1789 metais nustatė garsusis prancūzų chemikas Antuanas Loranas de Lavuazjė (Antoine Laurent de Lavoisier, 1743–1794), padėjęs šiuolaikinės chemijos pagrindus.
93 puslapyje pateiktame tyrime siūlėme deginti ir aliuminio foliją. Panagrinėkime šios cheminės reakcijos lygtį:
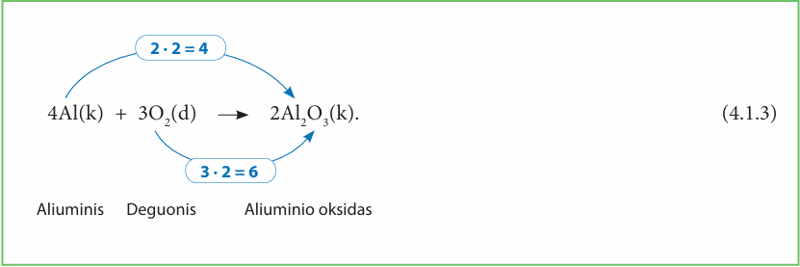
Suskaičiuokime. Aliuminiui sąveikaujant su deguonimi reikia 4 aliuminio atomų ir 3 dviatomių deguonies molekulių.
Taigi prieš reakciją buvo 4 aliuminio atomai. Vykstant reakcijai susidarė dvi aliuminio oksido (Al2O3) molekulės, t. y. 4 aliuminio jonai (prieš formulę rašomą koeficientą 2 dauginame iš 2 aliuminio atomų). Aliuminio dalelių skaičius kairiojoje ir dešiniojoje lygties pusėje sutampa.
Prieš reakciją buvo trys deguonies (O2) molekulės, arba 6 deguonies atomai (koeficientą 3 dauginame iš indekso 2). Įvykus reakcijai gautos dvi aliuminio oksido (Al2O3) molekulės, arba 6 oksido jonai (koeficientą 2 dauginame iš 3 deguonies atomų). Deguonies dalelių skaičius kairiojoje ir dešiniojoje lygties pusėje sutampa.
Taigi kiekvieno elemento dalelių skaičius prieš reakciją ir po jos yra lygus. Lygtis išlyginta.
Tai įdomu!
Vilniaus universitete nuo 1797 metų chemija buvo dėstoma taip pat kaip ir pažangiausiuose pasaulio universitetuose. Tai didžiulis Vilniaus universiteto profesoriaus, chemiko ir gydytojo Andriaus Sniadeckio (Jędrzej Śniadecki, 1768–1838), kuris studijavo Itãlijoje, Škòtijoje, nuopelnas (4.1.6 pav.). Vilniaus universitetas tapo stipriausia chemijos mokykla visoje carinėje imperijoje.
Klausimai ir užduotys
- Kokie yra cheminių reakcijų požymiai? Kuo jie skiriasi nuo fizikinių kitimų požymių?
- Ką reiškia cheminių reakcijų lygtyse nurodomi simboliai k, s, d, aq?
- Ličio ir deguonies cheminė reakcija užrašyta tokia lygtimi:
Li(k) + O2(d) → Li2O(k). Išlyginkite šios reakcijos lygtį. - Fosforas dega veikiamas deguonies. Susidaro fosforo oksidas. Reakcijos lygtis:
P(k) + O2(d) → P2O5(k). Išlyginkite šią lygtį. - Kurioje šių eilučių išvardytos tik cheminės reakcijos?
- Ledo tirpimas ir vandens garavimas
- Sieros degimas ir degimo produkto virtimas skysčiu
- Puvimas ir rūgimas
- Anglies dioksido virtimas sausu ledu ir jo sublimacija (virsmas garais aplenkiant skystąją būseną)
Ko išmokome?
- Cheminėmis reakcijomis vadiname kitimus, kuriems vykstant susidaro naujų – kitos sudėties, sandaros ir savybių – medžiagų.
- Cheminės reakcijos požymiai:
- spalvos pokytis;
- liepsnos atsiradimas;
- dujų išsiskyrimas;
- temperatūros pokytis;
- nuosėdų susidarymas tirpaluose.
- Elemento dalelių skaičius prieš reakciją ir po jos turi būti lygus.





