Skyriaus santrauka
- Cheminėmis reakcijomis vadiname kitimus, kuriems vykstant susidaro naujų – kitos sudėties, sandaros ir savybių – medžiagų.
- Spalvos, temperatūros pokytis, liepsnos atsiradimas, dujų išsiskyrimas, tirpių medžiagų nuosėdų susidarymas – tai cheminių reakcijų požymiai.
- Kiekvieno elemento dalelių skaičius prieš reakciją ir po jos turi būti lygus.
- Cheminės reakcijos gali būti skirstomos į keturis tipus:
- jungimosi, kai tarpusavyje susijungia dvi ar daugiau medžiagų;
- skilimo, kai medžiaga suskyla į dvi ar daugiau medžiagų;
- pavadavimo, kai vieninės medžiagos atomai pakeičia vieno iš sudėtinės medžiagos elementų atomus;
- mainų, kai medžiagos apsikeičia jonais viena su kita.
- Katalizatoriais vadinamos medžiagos, kurios pagreitina chemines reakcijas, bet pačios nėra sueikvojamos.
- Vykstant oksidacijos-redukcijos reakcijoms, vieni elementai atiduoda elektronus, o kiti juos prisijungia.
- Oksidacija vadinamas elektronų atidavimas.
- Redukcija yra elektronų prijungimas.
- Vykstant oksidacijos-redukcijos reakcijoms atiduodamų ir prijungiamų elektronų skaičius turi sutapti.
- Elemento oksidacijos laipsnis yra dydis, kuriuo parodoma, kiek elektronų galėtų prijungti ar atiduoti elementas, jei susidarytų joninis ryšys. Nurodant oksidacijos laipsnį krūvio ženklas rašomas prieš skaitmenį.
- Molekulės ir joninių junginių teigiamųjų ir neigiamųjų krūvių suma turi būti lygi nuliui.
- Cheminės medžiagos reaguoja tam tikromis proporcijomis.
- Medžiagos reaguoja tomis pačiomis proporcijomis, kokios yra tarp medžiagų dalelių.
- Skaičiuojant reakcijos medžiagų masę galima naudotis santykinės molekulinės masės skaitine reikšme, išreikšta gramais.
- Medžiagų masė prieš reakciją lygi medžiagų masei po reakcijos.
- Jei kurios nors pradinės medžiagos paimama per daug (perteklius), perteklinė medžiagos dalis nesureaguoja ir nedalyvauja reakcijoje.
- Cheminės reakcijos, kurioms vykstant energija išskiriama, vadinamos egzoterminėmis reakcijomis.
- Cheminės reakcijos, kurioms vykstant energija sunaudojama, vadinamos endoterminėmis reakcijomis.
- Energija, kurios reikia tam, kad prasidėtų cheminė reakcija, vadinama aktyvacijos energija.
- Jei susidariusių produktų energija yra mažesnė negu pradinių medžiagų, papildomai išsiskiria tam tikras energijos kiekis.
- Jei produktų energija yra didesnė už pradinių medžiagų energiją, tam, kad vyktų reakcija, reikia papildomos energijos.
- Cheminės reakcijos greitis matuojamas medžiagos kiekio kitimu per laiką.
- Katalizatorius padidina reakcijos greitį, nes sumažina reakcijos aktyvacijos energiją.
- Biologiniai katalizatoriai vadinami fermentais.
- Reakcijos greitis padidėja:
- padidinus medžiagų koncentraciją;
- pakėlus reakcijos temperatūrą;
- padidinus reaguojančiųjų kietųjų medžiagų paviršiaus plotą;
- panaudojus katalizatorių.
Pasitikrinu ir įsivertinu
- Persibraižykite lentelę ir joje įrašykite, koks yra nurodytasis medžiagos kitimas – fizikinis ar cheminis.
Kitimas | Fizikinis ar cheminis kitimas |
Degančios žvakės lydymasis | |
Aliuminio degimas | |
Mėlynių spalvos kitimas rūgštyse | |
Geležinės vinies rūdijimas | |
Ledo garavimas šaltyje | |
Anglies degimas | |
- Nurodykite, kurie teiginiai yra neteisingi.
- Elementų atomų skaičius prieš reakciją ir po jos yra lygus.
- Įvykus cheminei reakcijai susidaro nuosėdų.
- Įvykus cheminei reakcijai molekulės išlieka nepakitusios.
- Prieš prasidedant reakcijai molekulių yra daugiau nei šiai įvykus.
- Įvykus cheminei reakcijai susidaro naujų cheminių medžiagų.
- Toliau pateiktos skirtingo tipo reakcijos. Užrašykite šių reakcijų lygtis.
- skilimo;
- jungimosi;
- mainų;
- pavadavimo.
- Išlyginkite toliau pateiktas reakcijų lygtis ir nurodykite jų tipą: jungimosi, skilimo, pavadavimo ar mainų reakcija.
- Au2O3(k) → Au(k) + O2(d);
- P(k) + Cl2(d) → PCl5(k);
- MgCl2(aq) + KF(aq) → MgF2(k) + KCl(aq);
- Al(k) + CuCl2(aq) → AlCl3(aq) + Cu(k).
- Remdamiesi elementų elektrinio neigiamumo reikšmėmis, pateiktomis 3.1.1 lentelėje, nustatykite azoto oksidacijos laipsnį šiuose junginiuose:
- NH3;
- NO;
- NO2;
- NF3.
- Fosforą veikiant bromu, susidaro fosforo tribromidas (PBr3). Parašykite šios oksidacijos-redukcijos reakcijos lygtį. Nurodykite oksidatorių ir reduktorių. Išlyginkite lygtį elektronų balanso metodu.
- Apskaičiuokite, kiek gramų fosforo pentoksido gaunama sudeginus 6,2 g fosforo, esant deguonies pertekliui.
- 4,8 g magnio sumaišyta su 8 g bromo. Apskaičiuokite, kiek magnio bromido susidarė. Kurios pradinės medžiagos liko?
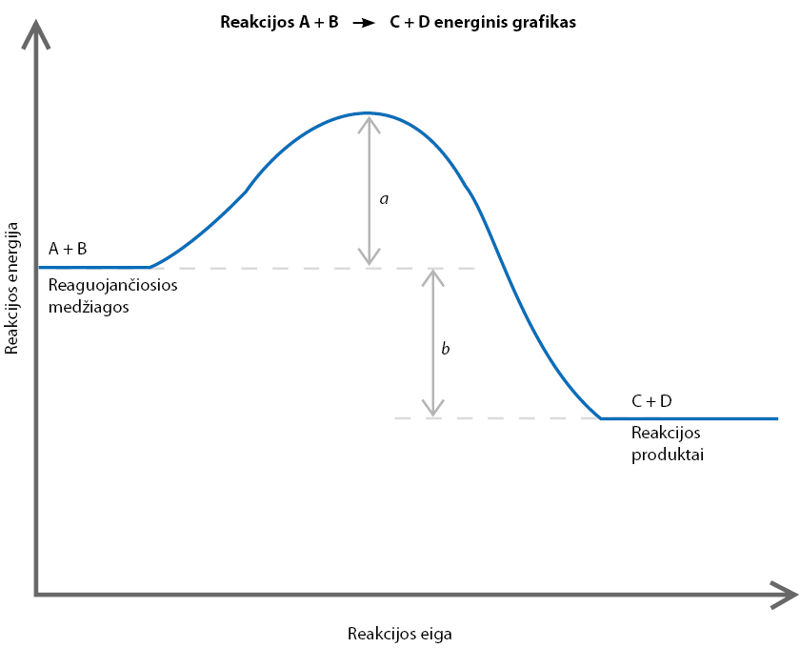
- Toliau pateiktas cheminės reakcijos A + B → C + D energinis grafikas. Nurodykite rodyklėmis pažymėtų atkarpų reikšmes (išskiriama ar šiai reakcijai sunaudojama šiluma; reakcijos aktyvacijos energija). Kokia reakcija – endoterminė ar egzoterminė – pavaizduota šiame grafike?
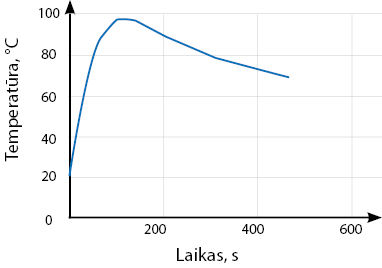
- Kalcio oksidą (negesintas kalkes) sumaišius su vandeniu santykiu 2:1, įvyko reakcija per kurią pakito mišinio temperatūra. Mišinio temperatūros kitimas pavaizduotas pateiktu grafiku.
- Paaiškinkite, kokia tai reakcija – endoterminė ar egzoterminė. Kas tai įrodo?
- Kaip atrodytų šios reakcijos kreivė, jei temperatūra būtų pamatuota po 600 sekundžių?
- Perpieškite grafiką į sąsiuvinį ir pabandykite nustatyti, kokia mišinio temperatūra būtų po 1200 sekundžių.
- Kodėl negesintas kalkes rekomenduojama maišyti su vandeniu metaliniame inde?
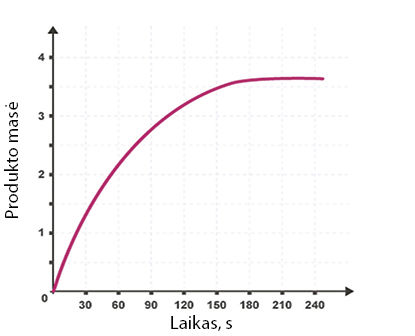
- Toliau pateiktame grafike pavaizduotas reakcijos A + B → C greičio kitimas per laiką.
Perpieškite šį grafiką. Šalia jau pavaizduotos kreivės nupieškite naujas, rodančias reakcijos greičio pokytį:
- esant aukštesnei temperatūrai;
- esant žemesnei temperatūrai;
- pridėjus katalizatoriaus.
Reakcijos A + B → C greičio kitimo grafikas
- Nurodykite, kaip pakis reakcijos greitis (padidės ar sumažės), pakeitus reakcijos sąlygas:
- susmulkinus reaguojančiąją medžiagą;
- padidinus reaguojančiosios medžiagos koncentraciją;
- sumažinus temperatūrą;
- pridėjus katalizatoriaus;
- vandeninį reaguojančiųjų medžiagų tirpalą praskiedus vandeniu;
- nuolat maišant kietosios reaguojančiosios medžiagos daleles.

