Cheminių reakcijų greitis
Vienos cheminės reakcijos vyksta labai greitai, kitos – lėtai. Žinome, kad labai lėtai vyksta rūdijimo, puvimo reakcijos. Organinės komposto medžiagos supūva per metus. Užraugtos daržovės surūgsta per kelias dienas. Tam, kad pažaliuotų varinis stogas, reikia šimtų metų (4.6.1 pav.).

Chèminės reãkcijos greitis matuojamas medžiagos kiekio kitimu per laiką.
Tačiau kai kurios reakcijos įvyksta akimirksniu, todėl jų greitį labai sunku išmatuoti. Ypač greitai vyksta sprogimo reakcijos (4.6.2 pav.). Pavyzdžiui, dujų ir oro mišinio degimo reakcija gali baigtis sprogimu ir sukelti labai skaudžių pasekmių.

Katalizatoriai
Vandenilio peroksido tirpalas skyla iškart, kai tik įpilama mielių (žr. 4.2 temą). Jau kalbėjome apie mielių poveikį. Savaiminis vandenilio peroksido skilimas vyksta labai lėtai. Mielės šį procesą labai paspartina. Tokias medžiagas, kurios pagreitina chemines reakcijas, bet pačios nėra sueikvojamos, pavadinome katalizatoriais.
Panagrinėkime cheminės reakcijos, kuri vyksta su katalizatoriumi ir be jo, energinę kreivę (4.6.3 pav.).
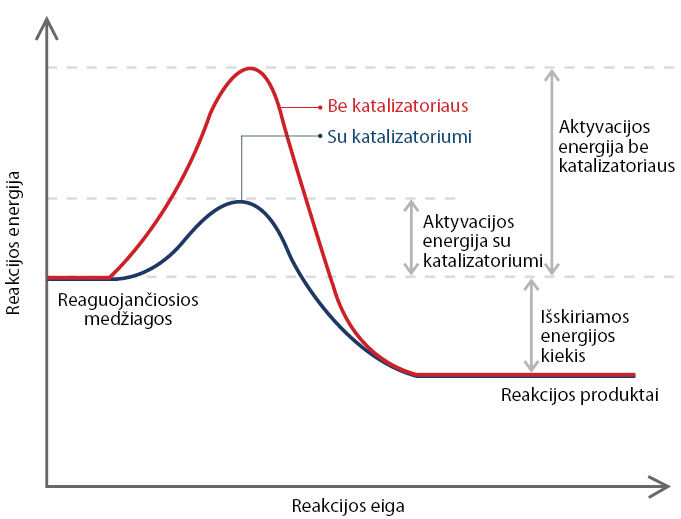
Kaip matome iš 4.6.3 paveikslo, katalizatoriai mažina reakcijos aktyvacijos energiją, todėl cheminė reakcija vyksta daug greičiau.
Katalizatorius padidina reakcijos greitį, nes sumažina reakcijos aktyvacijos energiją.
Biologiniai katalizatoriai – baltymai, didinantys reakcijų greitį gyvuosiuose organizmuose, – vadinami fermeñtais.
Tai įdomu!
Dar 1833 m. buvo nustatyta, kad seilėse yra medžiagų, kurios padeda virškinti maistą. Šios medžiagos pavadintos fermentais. Dabar žinoma, kad mūsų organizme yra apie 75 tūkstančius įvairių fermentų, kurie pagreitina vykstančias reakcijas, padeda virškinti maistą, įsisavinti medžiagas ir pan. Sutrikus virškinimui dažnai papildomai geriama fermentų turinčių vaistų. Skalbimo priemonėse esantys fermentai padeda greičiau suskaidyti nešvarumus.
Reakcijos greitį sąlygojantys veiksniai
Reakcijos greitis gali priklausyti nuo įvairių veiksnių: reaguojančiųjų medžiagų paviršiaus ploto, medžiagų koncentracijos, temperatūros.
Atlikime tyrimą ir patikrinkime, kaip cheminės reakcijos greitis priklauso nuo reaguojančiosios medžiagos koncentracijos. Ištirsime vandenilio peroksido skilimą veikiant mielėms ir esant indų ploviklio. Reakcijos lygtis:
2H2O2(s) → | 2H2O(s) + | O2(d). |
Vandenilio | Vanduo | Deguonis |
(4.6.1)
Tyrimas
Reakcijos greičio priklausomybė nuo reaguojančiosios medžiagos koncentracijos
Darbo tikslas: stebėti, kaip kinta reakcijos greitis pasikeitus reaguojančiosios medžiagos koncentracijai.
Jums reikės:
- 3 % vandenilio peroksido tirpalo;
- 7 g sausų kepimo mielių;
- 100 ml vandens;
- indų ploviklio;
- dviejų pipečių;
- vienos stiklinės;
- dviejų stiklinėlių;
- 4 mėgintuvėlių;
- mėgintuvėlių stovo;
- matavimo cilindro arba arbatinio ir valgomojo šaukšto;
- lazdelės maišyti.
Darbo eiga:
- Į stiklinę įpilkite 100 ml kambario temperatūros vandens ir suberkite 7 g sausų kepimo mielių.
- Gerai išmaišykite gautą mišinį.
- Į vieną stiklinėlę įpilkite 0,5 arbatinio šaukštelio indų ploviklio.
- Ten pat įpilkite 1 valgomąjį šaukštą (apie 15 ml) 3 % vandenilio peroksido tirpalo.
- Atsargiai išmaišykite šį mišinį, kad labai neputotų.
- Pipete paimkite po 1 ml peroksido tirpalo bei indų ploviklio mišinio ir įlašinkite į du mėgintuvėlius.
- Į šiuos mėgintuvėlius įlašinkite po 0,5 ml mielių mišinio ir atsargiai pamaišykite.
- Po 2 min pamatuokite iškilusių putų aukštį (4.6.4 pav.).
- Dabar pakartokite šį eksperimentą su atskiestu vandenilio peroksido mišiniu. Paruoškite mišinį iš 0,5 arbatinio šaukštelio ploviklio, 0,5 valgomojo šaukšto vandenilio peroksido ir 0,5 valgomojo šaukšto vandens.
- Į du švarius mėgintuvėlius pipete įlašinkite po 1 ml atskiesto peroksido tirpalo ir po 0,5 ml mielių mišinio. Atsargiai pamaišykite.
- Po 2 min pamatuokite putų aukštį.
- Palyginkite gautus rezultatus.
Paaiškinimas. Susidaręs deguonis išpučia ploviklio putas, pagal kurių aukštį galima spręsti apie reakcijos greitį. Atskiedus vandenilio peroksidą, reakcija vyksta lėčiau ir putų gaunama mažiau.

Reakcija vyksta greičiau, padidinus reaguojančiųjų medžiagų koncentraciją.
Dabar atlikime nesudėtingą tyrimą ir išsiaiškinkime, kaip reakcijos greitis priklauso nuo temperatūros.
Tyrimas
Reakcijos greičio priklausomybė nuo reaguojančiųjų medžiagų temperatūros
Darbo tikslas: stebėti, kaip kinta reakcijos greitis, pakeitus temperatūrą.
Jums reikės:
- 2 valgomųjų šaukštų skalbinių baliklio;
- 100 ml vandens;
- kelių lašų maistinių dažų;
- kaitlentės;
- 2 kaitinti tinkamų stiklinių;
- termometro;
- lazdelės maišyti;
- laikmačio.
Darbo eiga:
- Į dvi stiklines įpilkite šalto vandens.
- Vieną stiklinę su vandeniu pašildykite iki 40 °C temperatūros.
- Į abi vandens stiklines įlašinkite kelis lašus maistinių dažų.
- Į abi stiklines įpilkite po 1 valgomąjį šaukštą baliklio ir išmaišykite.
- Paleiskite laikmatį ir pamatuokite, per kiek laiko išnyko dažų spalva vienoje ir kitoje stiklinėje.
Paaiškinimas. Stiklinėje su pašildytu vandeniu dažų spalva išnyko daug greičiau negu stiklinėje su šaltu vandeniu.
Pakėlus reakcijos temperatūrą, reakcijos greitis padidėja.
Nustatyta, kad, reakcijos temperatūrą pakėlus 10 laipsnių, reakcijos greitis padidėja 2–3 kartus.
Norėdami, kad reakcija vyktų greičiau, medžiagas smulkiname. Pavyzdžiui, pjaustome daržoves, kad šios išvirtų greičiau, arba skaldome malkas, kad šios greičiau įsiliepsnotų. Susmulkinus padidėja medžiagų paviršiaus plotas. Vadinasi, atsiranda daugiau medžiagų tarpusavio sąveikos galimybių.
Padidinus reaguojančiųjų kietųjų medžiagų paviršiaus plotą, reakcijos greitis padidėja.
Atlikime tyrimą, kuriuo įrodysime šį teiginį.
Tyrimas
Reakcijos greičio priklausomybė nuo medžiagų paviršiaus ploto
Darbo tikslas: palyginti smulkinto ir nesmulkinto marmuro sąveiką su acto rūgštimi.
Jums reikės:
- 9 % acto rūgšties tirpalo;
- 4 nedidelių marmuro gabalėlių;
- grūstuvės su grūstuvėliu;
- 2 stiklinėlių;
- laikmačio.
Darbo eiga:
- Du marmuro gabalėlius susmulkinkite grūstuvėliu.
- Į 2 stiklinėles įpilkite po 50 ml acto rūgšties tirpalo.
- Į vieną stiklinėlę įmeskite du nesmulkintus marmuro gabalėlius.
- Į kitą stiklinėlę suberkite smulkintą marmurą.
- Stebėkite, kurioje stiklinėlėje susidarys daugiau dujų burbuliukų (4.6.5 pav.).
- Užfiksuokite laiką, per kurį visas marmuras ištirps kiekvienoje stiklinėlėje.
Paaiškinimas. Smulkintas marmuras reaguoja daug greičiau ir ištirpsta per trumpesnį laiką.
Pastaba. Tirpstant marmurui išsiskiria anglies dioksido dujos. Apie tokias reakcijas kalbėsime vyresnėse klasėse.


4.6.5 pav. Smulkinto ir nesmulkinto marmuro sąveika su acto rūgštimi
Klausimai ir užduotys
- Dėl kokių veiksnių padidėja cheminės reakcijos greitis?
- Nurodyta, kad skalbimo priemonėje yra fermentų. Ar skalbiant šiltame vandenyje nešvarumai bus greičiau išskalbti? Kaip manote, ar galima naudoti tokią priemonę skalbiant karštame vandenyje? Kodėl?
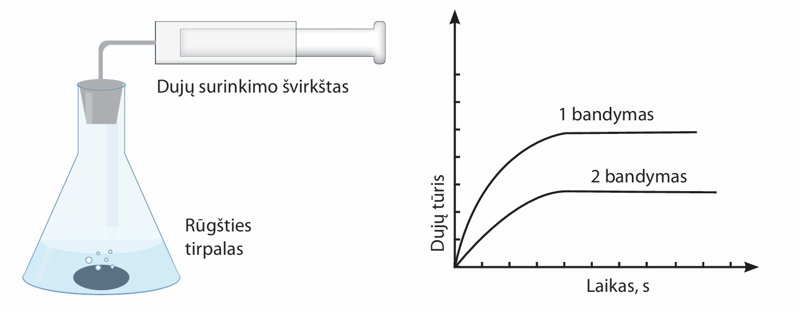
- Rūgštyje tirpinant metalinį cinką išsiskiria dujos. Mokinė atliko bandymą – du vienodus cinko gabalėlius ištirpino rūgštyje ir išmatavo išsiskyrusių dujų tūrį. Tada, pakeitusi vieną sąlygą, atliko antrąjį bandymą ir vėl įvertino išsiskyrusių dujų tūrį. Bandymo rezultatus pavaizdavo toliau pateiktame grafike. Kokią vieną sąlygą pakeitė mokinė?
- Sumažino rūgšties temperatūrą.
- Padidino rūgšties temperatūrą.
- Įmetė tik vieną cinko gabalėlį.
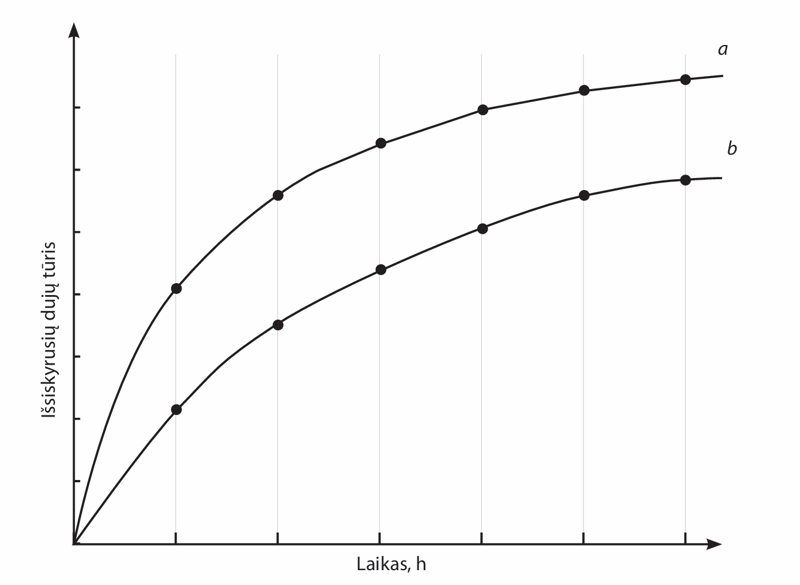
- Buvo tiriamas vandenilio peroksido skilimas veikiant mielėms. Gautas cheminės reakcijos greičio grafikas pavaizduotas tolesniame paveiksle. Kuri šių kreivių (a ar b) rodo, kad reakcija vyko šiek tiek pakėlus temperatūrą? Tarkime, kad abiem eksperimentams naudotas tas pats tūris tos pačios koncentracijos vandenilio peroksido. Ar abiem atvejais gautų dujų kiekis vienodas?
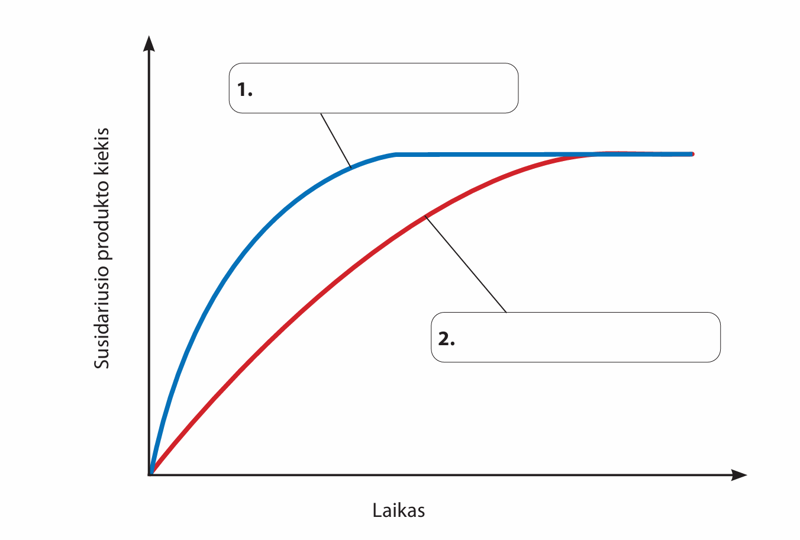
- Toliau pateiktame grafike pavaizduotas skirtingas marmuro tirpimo rūgštyje reakcijos greitis. Iš pateiktų variantų pasirinkite tinkamus veiksnius, dėl kurių pakinta minėtos reakcijos greitis. Kurį veiksnį į kurį grafiko langelį įrašytumėte?
- Žemesnė reakcijos temperatūra
- Aukštesnė reakcijos temperatūra
- Stambesnis marmuro gabaliukas
- Susmulkintas marmuro gabaliukas
- Didesnė rūgšties koncentracija
- Mažesnė rūgšties koncentracija
Ko išmokome?
- Cheminės reakcijos greitis matuojamas medžiagos kiekio kitimu per laiką.
- Katalizatorius padidina reakcijos greitį, nes sumažina reakcijos aktyvacijos energiją.
- Biologiniai katalizatoriai vadinami fermentais.
- Reakcijos greitis padidėja, padidinus medžiagų koncentraciją ar reaguojančiųjų kietųjų medžiagų paviršiaus plotą, pakėlus reakcijos temperatūrą, panaudojus katalizatorių.

