<...> žiedas, ant piršto nešiojamas daugelį metų,
iš apačios vis labiau be pertrūkio ima plonėti;
lašas po lašo varvėdamas akmenį prakala, riestas
arklo noragas laukuos pamažu geležinis sudyla <...>
<...> matome tat, daiktai nuo trinties visada sumažėja,
bet tų kūnų, kurie nuo daikto atsiskiria nuolat,
mūsų akims pavyduolė gamta neleido matyti1.
1Tai ištrauka iš Tito Lukrecijaus Karo (Titus Lucretius Carus, apie 97–55 m. pr. Kr.) poemos „Apie daiktų prigimtį“ (De rerum natura); leidykla „Mintis“, 1964, vertėjas M. Račkauskas. Lukrecijus – Ròmos filosofas, apibendrinęs senovės Graikijos mąstytojų teiginius apie medžiagų sandarą.
Tie kūnai, kurių „mūsų akims pavyduolė gamta neleido matyti“, – tai atomai. Prireikė beveik pustrečio tūkstantmečio, kol senovės Graikijos filosofų Leukipo ir Demokrito tezė, jog viskas sudaryta iš atomų, kad egzistuoja tik atomai ir tuštuma tarp jų, tapo visuotinai pripažinta tiesa.
Išnagrinėję šį skyrių, gebėsite:
- palyginti, kuo vieni izotopai skiriasi nuo kitų;
- paaiškinti, kaip išmatuojama atomo masė;
- iš masių spektro apskaičiuoti elemento santykinę atominę masę;
- apibrėžti, kas yra atominė orbitalė;
- paaiškinti, kokia seka elektronai užpildo orbitales;
- nusakyti atomo elektronų konfigūraciją – išsidėstymą atome;
- užrašyti elektronų konfigūracijos elektroninę formulę;
- pateikti radioaktyviųjų izotopų taikymo pavyzdžių;
- paaiškinti, kas yra pusėjimo trukmė.
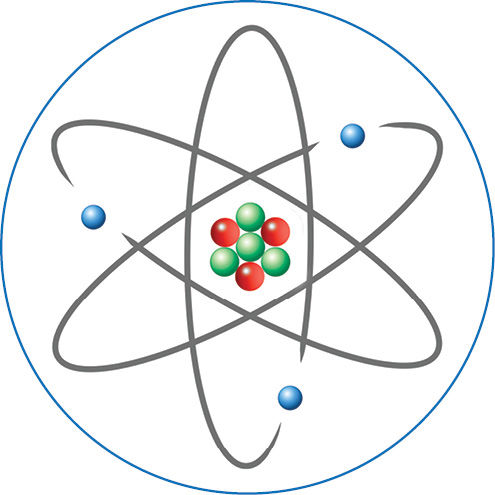
Atomą sudarančios dalelės
Atòmas, branduolỹs, protònas, neutrònas, elektrònas, atòminis skaičius, mãsės skaičius, chèminis elemeñtas, izotòpas, jònas, anijònas, katijònas.
Atomą sudarančios dalelės
„Atomas sudarytas iš teigiamai įelektrinto branduolio, kuriame sukaupta didžioji atomo masės dalis, ir elektronų. Visi elektronai yra vienodos masės ir turi neigiamąjį elektros krūvį. Jie juda aplink branduolį atstumu, kuris gerokai didesnis už branduolio ir pačių elektronų dydį. Atomas stulbinamai panašus į planetų sistemą, tokią, kokia yra mūsų Saulės sistema“, – taip 1922 metais atsiimdamas Nobelio premiją, suteiktą už atomo sandaros modelio sukūrimą, kalbėjo danų fizikas Nilsas Boras (Niels Bohr, 1885–1962).
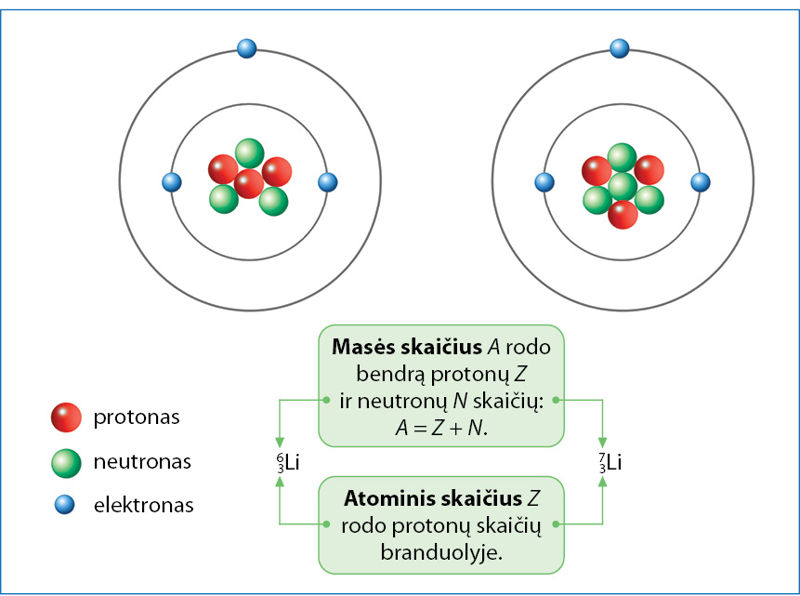
2.1.1 paveiksle parodyta dviejų ličio atomų sandara. Kiekvienas ličio atòmas turi tris protonùs ir tris elektronùs, o neutrònų būna trys arba keturi. Vienodą protonų skaičių turintys atomai priklauso tam pačiam chèminiam elemeñtui. Skirtingą neutronų skaičių turintys to paties elemento atomai vadinami izotòpais. Išnagrinėkite 2.1.1 paveikslą ir išsiaiškinkite, kaip žymimi ličio izotopai, ką rodo atòminis skaičius ir mãsės skaičius.
1 pavyzdys
Kuo panašūs ir kuo skiriasi vario-63 () ir vario-65 (
 | | | |
Sprendimas
Kairysis apatinis izotopo indeksas rodo atominį skaičių Z, o viršutinis – masės skaičių A.
Abu izotopai turi po 29 protonus ir elektronus. Jie skiriasi neutronų skaičiumi. Pirmasis turi 34, o antrasis – 36 neutronus.
Katijonai ir anijonai
Kol atomas turi tiek pat elektronų, kiek ir protonų, jis yra neutralus, neturi krūvio. Vykstant cheminėms reakcijoms elektronų skaičius gali pakisti, o protonų skaičius branduolyje nekinta. Jei atomas netenka dalies elektronų, jis tampa teigiamuoju jonu, dar vadinamu katijonù. Prisijungus papildomų elektronų, susidaro neigiamasis jonas, dar vadinamas anijonù.
2 pavyzdys
Kiek protonų, neutronų ir elektronų turi šios dalelės:
a)
 |  | | |
Sprendimas
- Anijonas (neigiamasis jonas)
S 2 - 16 34 - Katijonas (teigiamasis jonas)
Cr 3 + 24 50
Klausimai ir užduotys
- Paaiškinkite, ką rodo:
- atominis skaičius;
- masės skaičius.
- Nurodykite, kuo panašūs ir kuo skiriasi to paties elemento izotopai.
- Nurodykite, kiek protonų, neutronų ir elektronų turi:
Mg 12 24 Mg 2 + 12 25 O 2 - 8 18
- Palyginkite tris daleles:
Ne 22 Ne 23 Mg 2 + 24 - elektronų;
- protonų;
- neutronų?
- Kiek neutronų yra
Ca 20 48 - 20
- 48
- 28
- 68
- Gamtoje aptinkami du chloro izotopai. Vienas jų turi 18 neutronų, o kitas – 20. Parašykite šių izotopų simbolius, nurodydami atominį ir masės skaičių.
- Izotopo masės skaičius lygus 50. Žinoma, kad šio izotopo branduolyje neutronų yra šešiais daugiau nei protonų. Apie kokio elemento izotopą kalbama? Parašykite šio izotopo simbolį, nurodykite atominį ir masės skaičių.
- Dirbtinio izotopo masės skaičius lygus 90. Žinoma, kad šio izotopo branduolyje neutronų yra pusantro karto daugiau nei protonų. Kokio elemento izotopas aprašytas? Parašykite šio izotopo simbolį, nurodykite atominį ir masės skaičių.
