Santrauka
Visi dydžiai, kuriuos sužinome matuodami, yra apytiksliai. Kurie išmatuoto dydžio skaitmenys yra reikšminiai, priklauso nuo matavimo prietaiso. Tarpiniuose skaičiavimuose paliekame ne tik reikšminius, bet ir 1–2 papildomus (rezervinius) skaitmenis. Galutinį atsakymą apvaliname palikdami tik reikšminius skaitmenis.
Suma arba skirtumas po kablelio turi tiek reikšminių skaitmenų, kiek jų yra mažiausiai reikšminių skaitmenų po kablelio turinčiame pradiniame duomenyje. Sandauga ar dalmuo reikšminių skaitmenų turi tiek, kiek jų yra mažiausiai reikšminių skaitmenų turinčiame pradiniame duomenyje.
Medžiagos kiekis matuojamas moliais. 1 mol sudaro 6,022 · 1023 dalelių (molekulių, atomų, jonų, radikalų, elektronų ir t. t.).
Avogadro konstanta lygi 6,022 · 1023 1/mol, arba 6,022 · 1023 mol–1.
Standartinėmis sąlygomis temperatūra yra 0 °C, o slėgis 100 000 Pa, arba 1 bar.
Vienas molis dujų standartinėmis sąlygomis užima 22,7 dm3, arba 22,7 l, tūrį; Vm = 22,7 dm3/mol.
Cheminė formulė rodo, kokiu kiekių santykiu (moliais) susijungę atomai, o cheminė lygtis – kokiu kiekių santykiu (moliais) reaguoja ir susidaro medžiagos.
Jei reaguoja dujinės medžiagos, cheminė lygtis rodo ne tik kokiu kiekių santykiu, bet ir kokiu tūrių santykiu reaguoja medžiagos (jei dujų tūriai matuojami vienodomis sąlygomis).
Tirpalas sudarytas iš tirpiklio ir vieno ar daugiau tirpinių. Apibūdinant tirpalą nurodoma tirpinio procentinė koncentracija (masės dalis procentais), masės koncentracija (masė, tenkanti tūrio vienetui, pavyzdžiui, g/l, g/dm3) arba molinė koncentracija (kiekis moliais viename kubiniame decimetre (litre) tirpalo, mol/l, mol/dm3).
Vykstant reakcijai galimi reakcijos produktų nuostoliai. Išeiga rodo, kokią dalį apskaičiuoto produkto kiekio, masės ar tūrio pavyko gauti.
Praktinės užduotys
1. Linijinio grafiko nagrinėjimas
Mokiniai tyrė kalio dichromato K2Cr2O7 tirpumo priklausomybę nuo temperatūros, o gautus rezultatus pavaizdavo grafiku (1 pav.). Dydis, kuriuo rodoma, kiek daugiausia gramų medžiagos ištirpsta 100 g vandens, vadinamas tirpùmo koeficientù, arba tirpiù. Tirpumo koeficientas priklauso nuo temperatūros. Jeigu esant pasirinktai temperatūrai medžiagos daugiau ištirpti nebegali, tirpalas vadinamas sočiúoju.
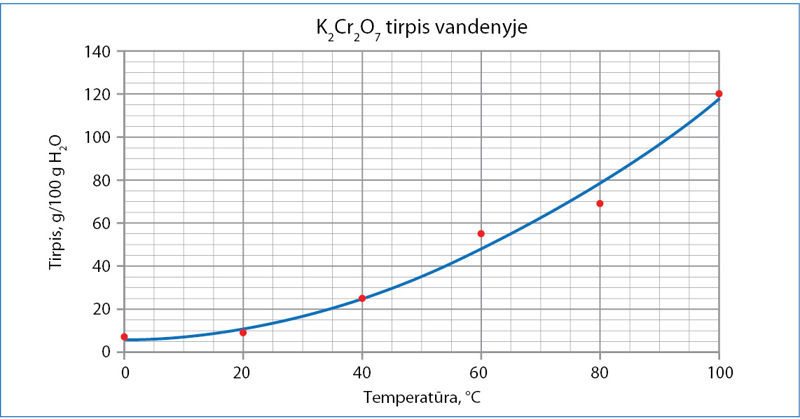
Naudodamiesi 1 paveikslo duomenimis, atsakykite į klausimus ir atlikite skaičiavimus.
- Paaiškinkite, kaip keičiasi kalio dichromato tirpis vandenyje didinant temperatūrą.
- Nurodykite kalio dichromato tirpį 40 °C ir 50 °C temperatūros vandenyje.
- Apskaičiuokite kalio dichromato masės dalį (procentinę koncentraciją) 40 °C temperatūros sočiajame tirpale.
- Sočiojo 40 °C temperatūros kalio dichromato tirpalo tankis 1,28 g/cm3. Kokį tūrį užima šis tirpalas, jei ištirpusio kalio dichromato masė yra 0,100 kg?
- Du taškai, tikėtina, nustatyti netiksliai. Kurie?
- Laikydami, kad tikrąjį tirpį rodo ne atidėti taškai, o nubrėžta kreivė, apskaičiuokite matavimų, atliktų esant 60 °C temperatūrai, absoliučiąją ir santykinę paklaidą.
- 0,250 kg sočiojo 50 °C temperatūros kalio dichromato tirpalo pašildyta iki 92 °C. Kiek gramų kalio dichromato galima papildomai ištirpinti pašildytame tirpale?
2. Linijinio grafiko sudarymas
Mokiniai tyrė etano (acto) rūgšties tirpalo tankio priklausomybę nuo šios medžiagos procentinės koncentracijos, o gautus rezultatus surašė lentelėje (1 lentelė). Visi matavimai atlikti esant 20 °C temperatūrai.
1 lentelė. Etano rūgšties tankio priklausomybė nuo procentinės koncentracijos
Procentinė koncentracija, % | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
Tankis, g/cm3 | 1,000 | 1,013 | 1,036 | 1,038 | 1,040 | 1,058 | 1,064 | 1,069 | 1,070 | 1,066 | 1,050 |
Sudarykite etano rūgšties tankio priklausomybės nuo procentinės koncentracijos linijinį grafiką. Braižydami grafiką vadovaukitės toliau pateiktais patarimais.
Patarimai
- Nepriklausomąjį dydį pažymėkite x ašyje, o nuo jo priklausomą dydį – y ašyje. Nepriklausomasis dydis yra tas, kurį mes patys galime pasirinkti ir keisti atlikdami tyrimus. Pavyzdžiui, gaminame skirtingos koncentracijos tirpalus (koncentracija – nepriklausomasis dydis) ir matuojame tirpalų tankį (tankis – priklausomasis dydis).
- Pasirinkite mastelį taip, kad didžioji dalis grafikui skirto ploto būtų išnaudota. Jei duomenys kinta ne nuo nulio ar artimo nuliui skaičiaus, grafiko ašies pradžioje gali būti nurodomas trūkis arba skalė pradedama ne nuo nulio. Ašis padalykite intervalais taip, kad intervalas būtų kartotinis skaičiams 1, 2, 5 arba 10. Venkite kartotinio 3, nes tada bus sunkiau skaičiuoti, kur pažymėti tašką.
- Užrašykite ašių pavadinimus ir matavimo vienetus.
- Užrašykite grafiko pavadinimą.
- Kruopščiai pagal mastelį pažymėkite taškus. Taškai gali būti žymimi nedideliais tuščiaviduriais arba pilnaviduriais skrituliais, kryželiais, trikampiais, kvadratais. Taškai turi būti tokio dydžio, kad nubrėžta tinkamiausia linija jų neuždengtų (taškai turi būti didesni už linijos storį).
- Jeigu viename grafike vaizduojate kelias duomenų serijas, skirtingų serijų taškus žymėkite skirtingai. Tokiu atveju prie grafiko reikia pateikti paaiškinimą, kurie žymėjimai kurią duomenų seriją rodo.
- Nubrėžkite dėsningumą geriausiai atspindinčią liniją. Ką reiškia „geriausiai atspindinčią“? Tai reiškia, kad negalima paprasčiausiai sujungti taškus. Daugeliu atvejų matavimų duomenys dėl paklaidų būna išsibarstę. Juos sujungę gausite laužtę, kuri vargu ar atspindės tikrąjį dėsningumą. Jei taškų yra pakankamai daug, ne mažiau kaip 5, galite įžvelgti dėsningumą (pamatyti, ar grafikas yra tiesės ar lanko pavidalo). Brėžkite gludžią liniją taip, kad ji būtų simetriška pažymėtiems taškams. Naudodamiesi elektroninėmis lentelėmis (pavyzdžiui, „Excel“ programa) pridėkite vadinamąją krypties liniją (angliškai trend line). Išbandykite įvairias krypties linijos parinktis (tiesę, eksponentę, daugianarį). Linijinio grafiko pavyzdys pateiktas ankstesnės užduoties 1 paveiksle.
Sudarę grafiką atsakykite į klausimus.
- Ar yra taškų, kurie, tikėtina, nustatyti netiksliai? Jei yra, kurie tai taškai?
- Koks yra 85 % etano rūgšties tirpalo tankis?
- Kokios sudėties etano rūgšties tirpalo tankis yra didžiausias?
- Sumaišyta 1,00 l grynos etano rūgšties ir 1,00 l gryno vandens. Apskaičiuokite susidariusio tirpalo tūrį. Uždaviniui išspręsti reikiamų duomenų rasite grafike.
3. Tirpalo gamyba ir tankio matavimas
Reikės:
Cukraus, vandens, dviejų cheminių stiklinių (250 ml arba didesnės tirpalui gaminti ir 50 ml tirpalo tankiui matuoti), svarstyklių, svėrimo indelio, 100 cm3 matavimo cilindro, stiklinės lazdelės arba plastikinio šaukštelio tirpalui maišyti, 20 cm3 pipetės, guminės kriaušės, liniuotės, milimetrinio grafikų popierius, iš anksto pagaminto nežinomos koncentracijos cukraus tirpalo (pavadinkime jį tirpalu X).
Tyrimo žingsniai
- Kiekvienas gausite individualią užduotį pagaminti 100 g tam tikros koncentracijos vandeninio sacharozės tirpalo. Sacharozės masės dalį (procentinę koncentraciją) mokytojas kiekvienam mokiniui paskirs skirtingą (patartina tarp 10 % ir 40 %). Gavę užduotį apskaičiuokite, kiek gramų cukraus ir kiek vandens reikia jums paskirto tirpalo gamybai. Nepamirškite visus skaičiavimus ir matavimus užsirašyti sąsiuvinyje.
- Reikiamą cukraus masę pasverkite svarstyklėmis. Vandens tankis labai artimas vienam gramui kubiniame centimetre. Reikiamą tūrį vandens paimkite matavimo cilindru. Vandenį supilkite į didesniąją cheminę stiklinę, suberkite cukrų ir ištirpinkite.
- Pasverkite tuščią mažąją cheminę stiklinę. Pipete paimkite 20,00 cm3 savo tirpalo (2 pav.), supilkite į stiklinę ir vėl pasverkite. Apskaičiuokite tirpalo tankį. Gautą rezultatą suapvalinkite palikdami tik reikšminius skaitmenis.
- Bendroje klasės rezultatų lentelėje užrašykite cukraus koncentraciją ir tirpalo tankį.
- Išmatuokite jums duoto tirpalo X tankį.
Duomenų analizė
- Naudodamiesi savo ir kitų mokinių gautais ir į bendrą lentelę įrašytais duomenimis, sudarykite linijinį grafiką, kuriuo būtų parodyta tirpalo tankio priklausomybė nuo cukraus procentinės koncentracijos. Nepamirškite, kad taškus reikia ne sujungti atkarpomis, o nubrėžti gludžią kreivę, aplink kurią bandymais nustatyti taškai būtų išsidėstę simetriškai.
- Naudodamiesi sudarytu grafiku, nustatykite cukraus procentinę koncentraciją jums duotame tirpale X.
- Mokytojo paklauskite, kokia yra tikroji cukraus procentinė koncentracija tirpale X, ir apskaičiuokite savo matavimo absoliučiąją ir santykinę paklaidą.
Papildomos užduotys
- Sprendžiant užduotį skaičiuotuvo ekrane įsižiebė virtinė skaitmenų. Suapvalinkite skaičiavimo rezultatą palikdami tris reikšminius skaitmenis.
1.
- 0,00205643 ≈
- 0,00021000 ≈
- 105,678 ≈
- 25464877,0879 ≈
- Tuščios 50,00 ml tūrio matavimo kolbos masė 89,456 g, o pripildytos acetono iki tūrio žymos matavimo kolbos masė 128,659 g. Apskaičiuokite acetono tankį.
2.
Ats.:
Keliais reikšminiais skaitmenimis jis nustatytas?
2.2
-
4
-
3
-
5
-
2
- Į 0,200 kg 15,0 % cukraus tirpalo papildomai įberta ir ištirpinta 0,050 kg cukraus. Kokia yra cukraus procentinė koncentracija naujajame tirpale?
3.
Ats.:
- Bandymui paimta 0,200 kg 15,0 % cukraus tirpalo ir pradėta šildyti. Šildant garuoja vanduo. Cukrus negaruoja. Kokia bus cukraus procentinė koncentracija, išgarinus 0,020 kg vandens?
4.
Ats.:
- Tirpinant vandenyje 0,200 kg sacharozės, pagaminta 15,0 % cukraus tirpalo. Kokia yra sunaudoto vandens masė?
5.
Ats.:
- Paimta 0,200 kg tirpalo, kuriame sacharozės masės dalis sudaro 15,0 %. Tirpalą pa kaitinus, dalis vandens išgaravo. Baigus garinti tirpalo masė buvo 0,190 kg. Į šį tirpalą papildomai įdėta ir ištirpinta 0,020 kg sacharozės. Apskaičiuokite sacharozės masės dalį (procentais) galutiniame tirpale.
6.
Ats.:
- Į vieną indą supilta 0,200 kg tirpalo, kuriame sacharozės masės dalis yra 15,0 %, ir 0,300 kg tirpalo, kuriame sacharozės masės dalis – 20,0 %. Apskaičiuokite sacharozės masės dalį naujajame tirpale.
7.
Ats.:
- Į matavimo cilindrą įpilta 30,0 ml etanolio C2H5OH, kurio tankis 0,789 g/cm3, ir praskiesta vandeniu tiek, kad tirpalo tūris būtų 300,0 cm3. Apskaičiuokite etanolio molinę koncentraciją. Nurodykite, kokių papildomų duomenų reikia, norint apskaičiuoti etanolio procentinę koncentraciją.
8.
Ats.:
- Vandenilio chlorido HCl dujas tirpinant vandenyje, gaunamas druskos rūgšties tirpalas. Šio tirpalo tankio priklausomybė nuo sudėties parodyta grafike (3 pav.).
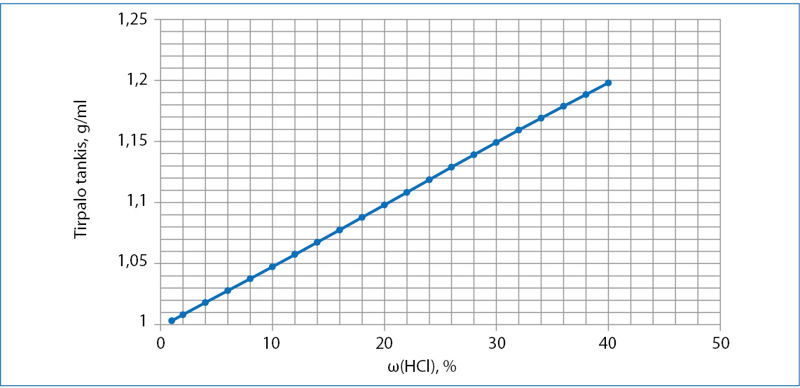
- Paaiškinkite, kaip kinta tirpalo tankis, didėjant vandenilio chlorido HCl koncentracijai.
- Sočiuoju vadinamas tirpalas, kuriame nebeįmanoma ištirpinti daugiau tirpinio. Esant 20 °C temperatūrai, HCl procentinė koncentracija sočiajame tirpale yra 40 %. Apskaičiuokite molinę HCl koncentraciją sočiajame tirpale.
9. b)
Ats.:
- Atidarant indą su didelės koncentracijos HCl tirpalu, reikia būti atsargiam dėl dviejų priežasčių. Apsitaškius šiuo tirpalu, pažeidžiama oda. Antroji priežastis – vandenilio chlorido lakumas, t. y. iš tokio tirpalo garuoja HCl dujos. Įkvėpus šių garų, pažeidžiami kvėpavimo takai. 35 % HCl tirpalas, kurio masė 100,0 g, ilgai stovėjo atviras, tad dėl vandenilio chlorido garavimo tirpalo tankis sumažėjo iki 1,15 g/ml. Apskaičiuokite susidariusio tirpalo masę. Tarkime, kad iš tirpalo garavo tik vandenilio chloridas.
9. c)
Ats.:
- Mokiniai tyrė amoniako tirpalo tankio priklausomybę nuo tirpinio koncentracijos. Atlikdami visas toliau pateiktas užduotis naudokitės jų sudarytu grafiku.
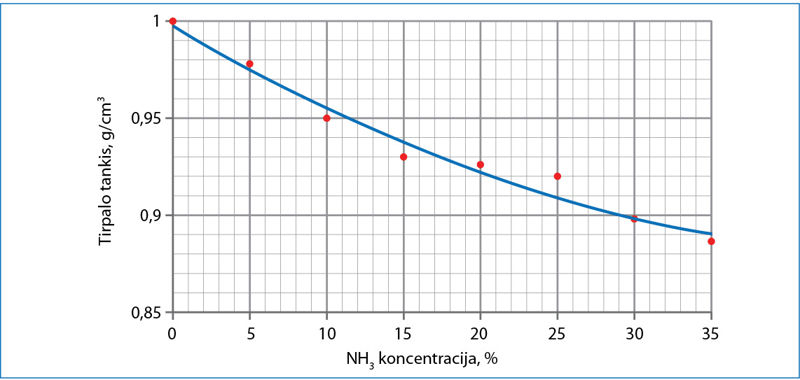
- Jūs tyrėte cukraus tirpalo tankio priklausomybę nuo cukraus koncentracijos. Kaip kito – didėjo ar mažėjo – tirpalo tankis, didinant cukraus koncentraciją? O kaip kinta tirpalo tankis, didinant amoniako koncentraciją?
- Kurie du taškai, tikėtina, nustatyti ne visai tiksliai? Apskaičiuokite abejonių keliančių matavimų absoliučiąją ir santykinę paklaidą, tikrąja reikšme laikydami nubrėžtos linijos duomenis.
- Kokia yra amoniako procentinė koncentracija, jei tirpalo tankis 0,950 g/cm3?
10. c)
Ats.:
- Apskaičiuokite, kokį tūrį užima 130,0 g tirpalo, kuriame amoniako koncentracija 32,0 %.
10. d)
Ats.:
- Bandymui reikia 180 cm3 12,0 % amoniako tirpalo. Kokia šio tirpalo mėginio masė?
10. e)
Ats.:
- Dviejose stiklinėse – A ir B – buvo du skaidrūs bespalviai skysčiai. Lėtai šildomi skysčiai išgaravo, tačiau A stiklinėje liko baltų nuosėdų, o B stiklinė liko tuščia. Pateikite pavyzdžių, kuriais atvejais būtų teisingi teiginiai:
- A stiklinėje buvo tirpalas, o B – grynoji medžiaga;
- ir A, ir B stiklinėje buvo tirpalai.
- Kalio junginyje K3XYZ (X, Y ir Z yra nežinomi elementai) kalio masės dalis sudaro 46,8 %. Kokia yra junginio K3XYZ molinė masė?
12.
Ats.:
- Kiek molių anglies yra 0,16 mol 2-hekseno mėginyje?
13.
Ats.:
- Nurodykite 2-hekseno, kuriame yra 0,18 mol anglies, kiekį (moliais).
14.
Aats.:
- Baltymai sudaryti iš aminorūgščių. Viena organizmo aminorūgščių – triptofanas C11H12N2O2 – naudojamas ne tik baltymų sintezei. Iš šios aminorūgšties susidaro serotoninas, užtikrinantis gerą miegą, nuotaiką ir gebėjimą mokytis. Triptofano dedama į kai kuriuos maisto papildus. Vieno papildo kapsulėje yra 150 mg triptofano.
Apskaičiuokite, kiek šioje kapsulėje yra:
- triptofano molekulių (jų skaičių);
15. a)
Ats.:
- azoto (kiekį moliais);
15. b)
Ats.:
- anglies (kiekį moliais).
15. c)
Ats.:
Apskaičiuokite:
- triptofano, kuriame yra 0,44 mol anglies, masę;
15. d)
Ats.:
- triptofano, kuriame yra 3,6 · 1023 vandenilio atomų, masę;
15. e)
Ats.:
- triptofane esančio deguonies masės dalį (procentais).
15. f)
Ats.:
- Cholesterolio C27H46O koncentracija kraujyje 4,55 mmol/dm3. Apskaičiuokite cholesterolio:
- masės koncentraciją, išreikštą g/dm3;
16. a)
Ats.:
- molekulių skaičių viename kubiniame decimetre kraujo.
16. b)
Ats.:
- Parašykite ir išlyginkite etano degimo esant deguonies pertekliui lygtį. Apskaičiuokite:
- masę anglies dioksido, susidariusio deginant 45 g etano;
17. a)
Ats.:
- tūrį sudeginto etano, jei susidarė 18 dm3 anglies dioksido (tūris matuojamas vienodomis sąlygomis);
17. b)
Ats.:
- sudeginto etano molekulių skaičių, jei surinkta 0,22 kg anglies dioksido, tačiau žinoma, kad šios medžiagos išeiga yra 95 %;
17. c)
Ats.:
- vienos etano molekulės masę gramais.
17. d)
Ats.:
- Alkenams ar alkinams atpažinti tinka bromo Br2 tirpalas. Bromas ištirpinamas, pavyzdžiui, tetrachlormetane CCl4. Gaunamas rusvas tirpalas. Reaguodamas su nesočiuoju angliavandeniliu, tirpalas praranda rusvą spalvą, išblunka. Tai rodo, kad įvyko jungimosi reakcija. 0,015 mol propeno išblukino 0,15 kg bromo Br2 tirpalo. Apskaičiuokite bromo masės dalį (procentais) tirpale.
18.
Ats.:
- Bromas ištirpintas tetrachlormetane. Bromo masės dalis šiame tirpale 1,25 %. Į tirpalą įleidus 0,025 mol propeno dujų, tirpalo spalva išbluko. Apskaičiuokite bandymui paimto bromo tirpalo masę.
19.
Ats.:
- Bandymui paimta 50,0 g 0,50 % bromo tirpalo. Kiek gramų 2-hekseno reikia įpilti į šį tirpalą, kad jo spalva išbluktų?
20.
Ats.:
- Lietuvõs bankas 2023 m. išleido proginę 10 eurų monetą, skirtą Abiejų Tautų Respublikos Edukacinės komisijos (t. y. pirmosios švietimo ministerijos Euròpoje) 250 metų sukakčiai paminėti. Monetos sudėtyje yra 21,55 g gryno sidabro, kurio masės dalis 92,50 % (t. y. sidabro praba 925). Apskaičiuokite šios monetos masę.

21.
Ats.:

