1904 m. Nobelio premija chemijos srityje skirta Viljamui Ramziui (William Ramsay, 1852–1916) už inertinių dujų atradimą. Pirmąsias atrastas inertines dujas jis pavadino argonu (graikiškai argos – „tingus“). Šį pavadinimą argonas pelnė dėl savo cheminio inertiškumo. Beje, visu šimtmečiu anksčiau Henris Kavendišas (Henry Cavendish, 1731–1810) oro mėginį prisotino deguonies ir leido elektros išlydžius. Taip jis privertė azotą jungtis su deguonimi. H. Kavendišas nustatė, kad 1/125 oro tūrio dalis (t. y. 0,8 %) nesijungia nei su azotu, nei su deguonimi ir, tikėtina, yra kažkokios kitos dujos. Dabar nustatyta argono tūrio dalis ore 0,9 %. Tad H. Kavendišas jau buvo aptikęs argoną gerokai anksčiau už V. Ramzį, bet neįrodė, kad tai nauja medžiaga. Kodėl inertinės dujos tokios nereaktyvios? Cheminės reakcijos susijusios su elektroninės sandaros pokyčiais. Tad inertiškumo priežastis gali būti inertinių dujų elektroninės sandaros ypatumai – jos turi visiškai užpildytas išorinio sluoksnio s ir p orbitales – vadinamąjį elektronų oktetą (helis turi užpildytą s orbitalę). Elektronų okteto idėja pasitarnavo aiškinant cheminio ryšio susidarymą – atomai atiduoda, prisijungia arba bendrina elektronus ir taip įgyja sandarą, panašią į inertinių dujų.
Beje, inertinės dujos ne visai inertinės. Jau senokai pavyko susintetinti kriptono, ksenono junginius, o 2000-aisiais metais paskelbta apie argono junginį HArF, tiesa, egzistuojantį tik žemesnėje nei –256 °C temperatūroje.
Išnagrinėję šį skyrių, gebėsite:
- paaiškinti joninių junginių susidarymą;
- nusakyti joninio kristalo sandarą ir savybes;
- paaiškinti kovalentinio ryšio susidarymą;
- nurodyti kovalentinio nepolinio ir kovalentinio polinio ryšio skirtumus;
- išvardyti nemolekulinės sandaros kovalentinių junginių sandaros ypatumus;
- palyginti skirtingais cheminiais ryšiais susijusių medžiagų savybes;
- paaiškinti cheminio ryšio susidarymą koordinaciniu būdu; nustatyti metališkojo ryšio susidarymą ir savybes;
- paaiškinti tarpmolekulinio ryšio susidarymą;
- nusakyti tarpmolekulinio ryšio įtaką medžiagų savybėms;
- pateikti vandenilinio ryšio susidarymo biologiškai svarbiose medžiagose pavyzdžių.
Joninis ryšys ir joninis kristalas
Inèrtinės dùjos, oktètas, oktèto taisỹklė, jònas, jòninis ryšỹs, jòninis kristãlas, formulinis vienetas, elektròninė fòrmulė, elektrònų konfigūrãcija, paprastàsis jònas, sudėtinis jònas.
18-osios (kitaip VIIIA) grupės elementai iš visų elementų išsiskiria savo pasyvumu, cheminiu inertiškumu. Helio, neono ir argono atomai junginių apskritai nesudaro. Kriptono, ksenono ir radono junginiai žinomi, tačiau nėra labai gausūs, be to, juos sunku susintetinti. Įprastomis sąlygomis šie elementai yra vienatomės dujos, t. y. nesijungia net ir tarpusavyje. Dėl šių savybių 18-oji periodinės lentelės grupė pavadinta inèrtinių dùjų grupe.
Okteto taisyklė
18-osios grupės elementai (išskyrus helį) išoriniame sluoksnyje turi aštuonis elektronus. Tai vadinamasis elektronų oktètas. Pastebėjęs šią sąsają tarp inertiškumo ir elektroninės sandaros, G. N. Luisas pasiūlė oktèto taisyklę – susijungiančių atomų elektroninė sandara pakinta taip, kad kiekvieno jų išoriniame sluoksnyje būtų aštuoni elektronai. Elektronų išsidėstymas atome vadinamas jo elektronų konfigūracija. Ji užrašoma vienokia ar kitokia elektronine formule.
Stabili, panaši į inertinių dujų, elektronų konfigūracija įgyjama:
- prisijungiant papildomai elektronų;
- netenkant elektronų (tada išoriniu tampa priešpaskutinis sluoksnis);
- dalijantis elektronais (sudarant bendrąsias elektronų poras).
Jonų susidarymas
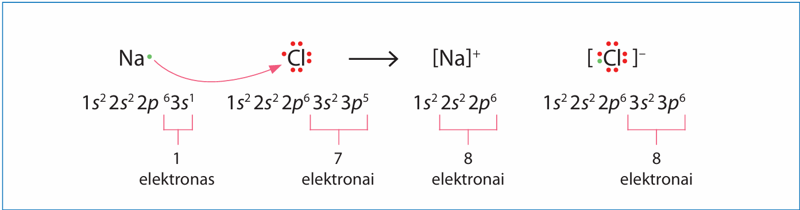
Nemetalų atomai išoriniame sluoksnyje turi keturis ir daugiau elektronų. Jie gali atimti elektronus iš metalų atomų ir taip papildyti savo išorinį sluoksnį iki stabilaus aštuonių elektronų rinkinio. Metalų atomai išoriniame sluoksnyje turi vieną, du arba tris elektronus. Šių netekus, išoriniu tampa priešpaskutinis sluoksnis, jau užpildytas aštuoniais elektronais. Dėl tokio elektronų persiskirstymo metalo atomas tampa teigiamuoju, o nemetalo – neigiamuoju jonu (3.1.1 pav.). Natrio jono Na+ elektronų konfigūracija sutampa su neono, o chlorido jono Cl– – su argono elektronų konfigūracija. Abu jonai įgijo tokį pat elektronų apvalkalą, kokį turi inertinių dujų atomai.
Nemetalų atomai atima valentinius elektronus iš metalų atomų. Nemetalų atomai tampa neigiamaisiais, o metalų atomai – teigiamaisiais jonais.
1 pavyzdys
- Luiso formule parodykite jonų susidarymą iš magnio ir fluoro atomų.
- Nurodykite, kurių inertinių dujų elektroninę formulę įgyja susidarantys jonai.
Sprendimas
-
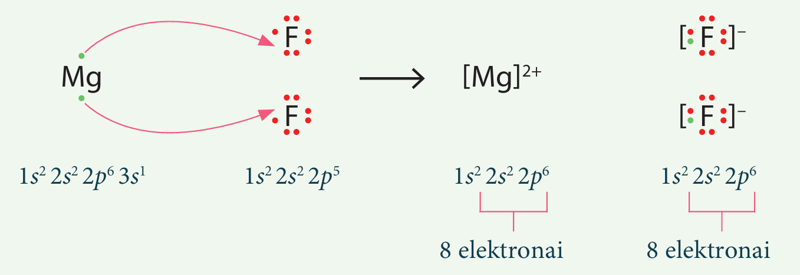
- Abu jonai įgyja tokį išorinį elektronų sluoksnį, kokį turi neonas.
Joninis ryšys ir kristalas
Priešingą krūvį turintys jonai traukia vienas kitą. Ši trauka ir yra jòninis ryšỹs.
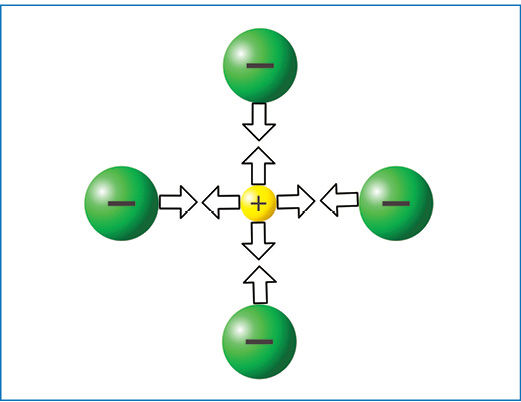
Metalui jungiantis su nemetalu, susidaro joninis ryšys.
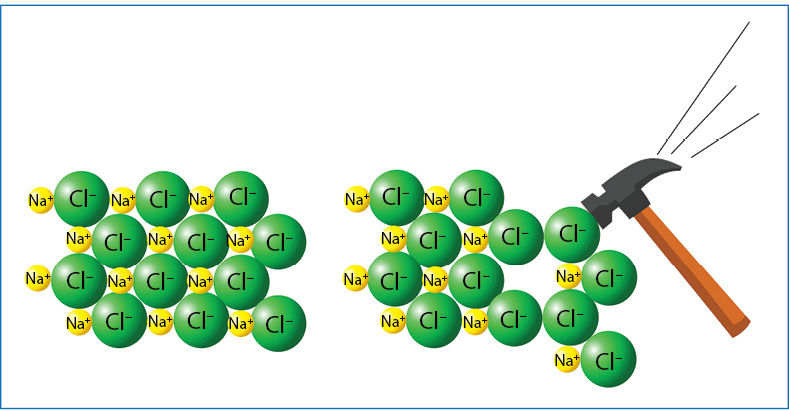
Teigiamieji jonai traukia neigiamuosius (ir atvirkščiai), o vienodo ženklo krūviai vienas kitą stumia. Trauka tarp jonų nėra nukreipta kuria nors viena kryptimi. Teigiamasis jonas traukia visus neigiamuosius jonus, nesvarbu, kurioje pusėje tie jonai yra (3.1.2 pav.). Dėl traukos tarp priešingo ženklo krūvių ir stūmos tarp to paties ženklo krūvių jonai išsidėsto tvarkingai. Susidaro vadinamasis jòninis kristãlas (3.1.3 pav.).
Kiek jonas gali pritraukti priešingo ženklo jonų? 3.1.2 paveiksle parodyta vieno teigiamojo jono sąveika su keturiais neigiamaisiais. Artimiausioje aplinkoje esančių neigiamųjų jonų skaičius priklauso nuo jonų dydžio. Aplink mažo spindulio joną telpa nedaug didelio spindulio jonų, o aplink didelį joną telpa daug mažų. Be to, teigiamasis jonas traukia ne tik artimiausius neigiamuosius jonus. Jis traukia ir toliau esančius jonus. Tiesa, atstumui didėjant, traukos jėga silpsta. Tad kiekvienas teigiamasis jonas traukia visus joniniame kristale esančius neigiamuosius jonus. Joniniame kristale veikia vientisas traukos ir stūmos jėgų tinklas. Nėra ribos, kiek konkrečiai jonų gali sudaryti joninį kristalą. Valgomoji druska yra natrio chloridas NaCl. Nusipirkę rupios valgomosios druskos, galite rasti įvairaus dydžio kristalų. Esant palankioms sąlygoms, gali susidaryti milžiniškų joninių medžiagų kristalų.
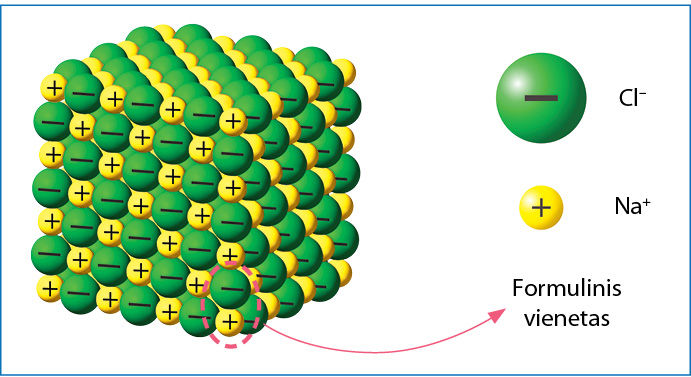
Formulinis vienetas
Joninis kristalas yra vieninga tvarkingai išsidėsčiusių teigiamųjų ir neigiamųjų jonų sistema. Joninių junginių atveju nėra molekulių. Viso junginio sudėtį atspindinčią mažiausią jonų grupę vadiname formuliniù vienetu, bet ne molekule. Natrio chlorido formulinį vienetą sudaro vienas natrio ir vienas chlorido jonas (3.1.3 pav.). Tad formulė NaCl rodo ne molekulę, o formulinį vienetą.
2 pavyzdys
a) Luiso formule parodykite jonų susidarymą iš aliuminio ir deguonies atomų.
Nurodykite:
b) kurių inertinių dujų elektroninę formulę įgyja susidarantys jonai;
c) kokia yra susidarančio junginio formulinio vieneto sudėtis.
Sprendimas
-
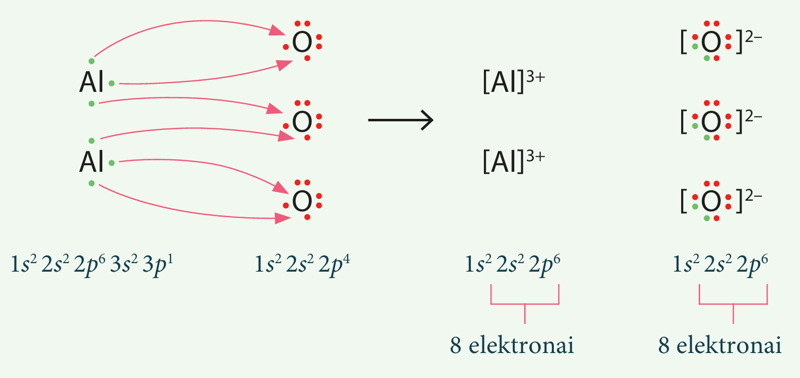
- Tiek aliuminio, tiek oksido jono elektroninė formulė sutampa su neono elektronine formule.
- Formulinis vienetas sudarytas iš 5 jonų: dviejų aliuminio ir trijų oksido; jis atitinka formulę Al2O3.
Kas didesnis?
3.1.4 paveiksle parodytas natrio ir chloro atomų bei jonų dydis. Šių elementų atomai turi po tris elektronų sluoksnius, bet chloro branduolio krūvis (+17) gerokai didesnis už natrio (+11). Vadinasi, chloro branduolys išorinio sluoksnio elektronus traukia stipriau ir prisitraukia arčiau. Todėl, nors ir turi daugiau elektronų, chloro atomas yra beveik dvigubai mažesnis už natrio atomą.
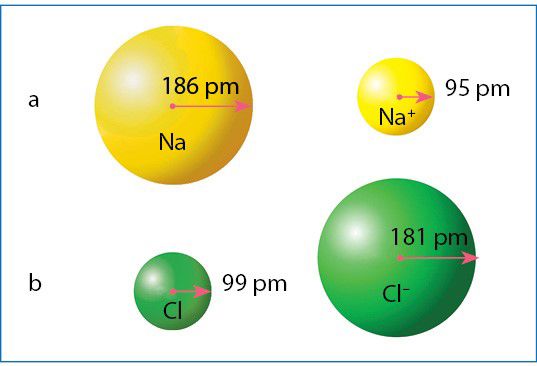
Natrio atomo elektronai išsidėstę trimis sluoksniais, o natrio jonas Na+ beturi du sluoksnius. Sumažėjus sluoksnių skaičiui, sumažėja ir dalelės spindulys (3.1.4. pav., a). O štai chloro atomas virsdamas chlorido jonu gerokai padidėja (3.1.4 pav., b). Tai lemia elektronų tarpusavio stūma. Pagausėjus elektronų, išauga stūmos jėgos, o branduolys lieka toks pat. Todėl jonas padidėja. Atkreipkite dėmesį į joninio kristalo piešinį (3.1.3 pav.). Anijonai parodyti gerokai didesni už katijonus.
Kai atomas virsta katijonu (teigiamuoju jonu), spindulys sumažėja, o kai virsta anijonu (neigiamuoju jonu) – padidėja.
Joninio kristalo fizikinės savybės
Joniniame kristale visi jonai sąveikauja su visais. Dėl tokios visą kristalą apimančios sąveikos joninės medžiagos turi daug panašumų.
- Kambario temperatūroje visos joninės medžiagos yra kietosios būsenos. Jų lydymosi ir virimo temperatūra gana aukšta. Taip yra todėl, kad, pavyzdžiui, norint išlydyti valgomąją druską NaCl, reikia nutraukti daugybę joninių ryšių. Tam reikia daug energijos, kuri suteikiama kaitinant. Susietų joniniais ryšiais jonų padėtis lieka fiksuota. Tik nutraukus šiuos ryšius medžiaga virsta skysčiu.
- Deformuojamas (smūgiuojamas, stipriai spaudžiamas) kristalas skyla ar net sutrupa į miltelius (3.1.5 pav.).
- Dalis joninių medžiagų tirpsta vandenyje (žr. 11 priedą) ir kituose poliniuose tirpikliuose (apie poliškumą kalbėsime šiek tiek vėliau, kai nagrinėsime kovalentinius ryšius). Joninės medžiagos netirpsta aliejuje, benzine, dyzeline ir kituose nepoliniuose tirpikliuose.
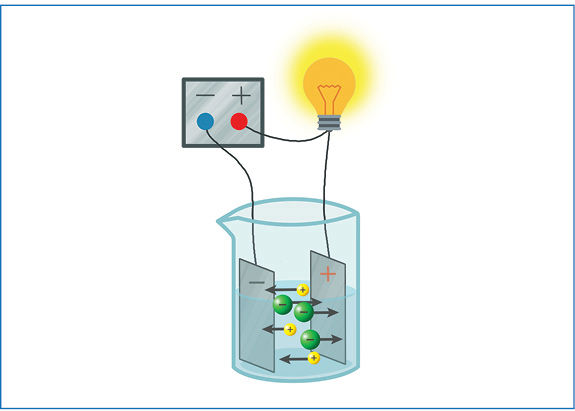
- Elektros srovė – tai kryptingas krūvį turinčių dalelių judėjimas. Joniniame kristale jonai negali laisvai judėti, todėl kristalinės būsenos joninės medžiagos nelaidžios elektros srovei. Lydomas arba tirpinamas vandenyje joninis kristalas išyra, todėl joninių medžiagų lydalai ir tirpalai laidūs elektros srovei (3.1.6 pav.).
Joninių medžiagų lydymosi ir virimo temperatūra
Junginio formulė | Lydymosi temperatūra, °C | Virimo temperatūra, °C |
NaCl | 801 | 1465 |
CaBr2 | 730 | 1815 |
Al2O3 | 2072 | 2977 |
Pereinamųjų metalų jonų elektronų konfigūracija
Pereinamųjų metalų (3–12 grupės) jonų elektroninė sandara ne visada sutampa su inertinių dujų. Šių metalų valentiniai elektronai yra paskutinio, išorinio, sluoksnio s orbitalėje ir priešpaskutinio sluoksnio d orbitalėse. Virsdami teigiamaisiais jonais, jie pirmiausia netenka išorinio sluoksnio (t. y. s orbitalės) elektronų ir tik tada – priešpaskutinio sluoksnio d orbitalių elektronų.
3 pavyzdys
Kokia yra titano Ti2+, Ti3+ ir geležies Fe2+ bei Fe3+ jonų elektroninė sandara?
Sprendimas
Ti | – 2e– → | Ti2+. |
Ti | – 3e– → | Ti3+. |
Fe | – 2e– → | Fe2+. |
Fe | – 3e– → | Fe3+. |
Komentaras. Geležies Fe3+ jonai stabilesni, junginiuose dažnesni nei Fe2+ jonai. Tai siejama su simetriška Fe3+ jono elektronų konfigūracija – jo visose 3d orbitalėse yra po vieną elektroną (prisiminkite chromo ir vario atomų elektroninės sandaros ypatumus).
Paprastieji ir sudėtiniai jonai
Iki šiol nagrinėti jonai vadinami paprastaisiais, jie sudaryti tik iš vieno jonu virtusio atomo. Iš kelių atomų sudaryti jonai – ,
Klausimai ir užduotys
- Brėžiniais pavaizduokite jonų susidarymą iš pateiktų atomų ir nurodykite formulinio vieneto sudėtį:
- Ca ir O;
- Ca ir F;
- Li ir Br;
- Li ir S (žr. 1 ir 2 pavyzdį).
- Parašykite, kiek elektronų turi pateikti jonai. Jei jų elektroninė sandara sutampa su inertinių dujų, nurodykite, kurių:
- O2–;
- K+;
- I–;
- Ca2+.
- Ketvirtojo periodo pereinamųjų (3–12) grupių elementai virsdami jonais pirmiausia netenka ketvirtojo sluoksnio ir tik tada – trečiojo sluoksnio elektronų. Parašykite, kiek nurodyti jonai turi elektronų ir kaip jie pasiskirstę orbitalėse (t. y. parašykite jonų elektronines formules). Kiekvienu atveju nurodykite, ar jono elektroninė sandara sutampa su inertinių dujų sandara.
- Sc3+;
- Ti2+;
- Cr2+;
- Cr3+;
- Cu+;
- Cu2+.
- Kurios cheminės formulės yra joninių junginių (junginių, kuriuose bent dalis ryšių yra joniniai):
- NaBr;
- HBr;
- BaCl2;
- K2SO4;
- Rb2O;
- LiNO3;
- NH4NO3?
- Mokiniai užaugino 56,9 g masės kalio aliuminio sulfato kristalohidrato KAl(SO4)2 · 12H2O kristalą.
- Nurodykite, kokių jonų yra šiame kristale.
- Apskaičiuokite šių jonų skaičių kristale.
- Jonai N3–, O2–, F–, Na+, Mg2+ ir Al3+ parašyti jų spindulio mažėjimo tvarka. N3– jono spindulys 132 pm, o Al3+ – 68 pm. Išnagrinėkite šių jonų sandarą ir nurodykite:
- po kiek elektronų kuriame sluoksnyje turi šie jonai;
- su kurių inertinių dujų elektronine sandara sutampa šių jonų sandara;
- koks kiekvieno jono branduolio krūvis.
Remdamiesi šių jonų sandaros ypatumais, paaiškinkite, kodėl iš pateiktų jonų nitrido jonas N3– yra didžiausio, o aliuminio jonas Al3+ – mažiausio spindulio.
- Palyginkite jonų S2–, Cl–, K+ ir Ca2+ sandarą. Kuo jie panašūs ir kuo skirtingi?
- Raskite internete kristalų auginimo aprašymų ir pabandykite patys išauginti joninių kristalų.