Junginių cheminių formulių sudarymo taisyklės
Mokydamiesi sudaryti junginių chemines formules, sužinojome šias svarbiausias taisykles:
- Elementų prijungiamų ir atiduodamų elektronų skaičius turi būti vienodas.
- Kovalentinių junginių formulės sudaromos panašiai kaip ir joninių junginių; svarbu prisiminti, kad šiuo atveju elektronai visiškai neatiduodami.
- Susidarant kovalentiniam ryšiui elektronai sudaro bendrą elektronų porą.
- Vienas kovalentinis ryšys reiškia vieną bendrą elektronų porą.
- Vienas atomas gali sudaryti tik 4 bendras elektronų poras.
- Vieninių medžiagų molekulės susidaro elemento atomams suformavus bendras elektronų poras. Vieninės medžiagos gali jungtis ir į gana dideles molekules arba darinius, kuriuose atomų skaičius yra neapibrėžtas.
Junginių cheminės formulės gali būti vaizduojamos įvairiais būdais, parodant cheminių ryšių skaičių. Susipažinkime su pagrindiniais cheminių formulių žymėjimo būdais.
Taškinės formulės
Formulė, kurioje cheminis ryšys vaizduojamas taškais, vadinama taškinè.
Taškinės formulės rodo elemento atomo arba junginį sudarančių elementų atomų išorinio sluoksnio elektronų išsidėstymą. Kiekvienas elektronas žymimas tašku. Elektronai yra linkę sudaryti poras, o susijungusių atomų laisvieji išorinio sluoksnio elektronai – bendras elektronų poras. Pavyzdžiui, vandenilio atomas turi vieną elektroną. Į vandenilio molekulę susijungę atomai sudaro bendrą elektronų porą, kuri vaizduojama taškais tarp vandenilio atomų simbolių. Remdamiesi 3.6.1 ir 3.6.2 paveikslais, parašykime vandens, anglies dioksido, metano ir vandenilio molekulių taškines formules (3.8.1 pav.):
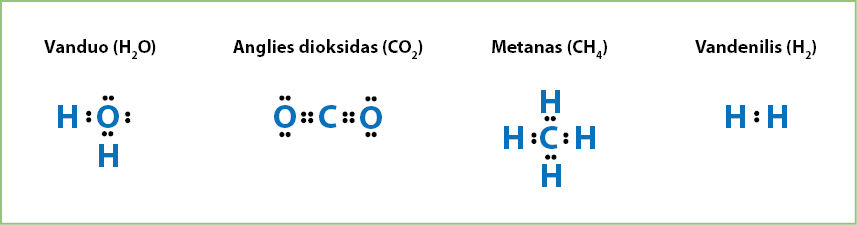
Kiekviena bendra elektronų pora žymi vieną cheminį ryšį. Tokios formulės dar vadinamos Lùiso fòrmulėmis, pavadintomis jų kūrėjo Gilberto Niutono Luiso (Gilbert Newton Lewis, 1875–1946) garbei.
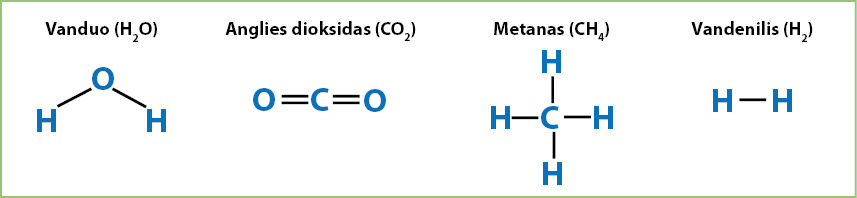
Struktūrinės formulės
Formulė, kurioje cheminis ryšys vaizduojamas brūkšniais, vadinama struktūrine.
Cheminiai ryšiai gali būti vaizduojami ir brūkšniais. Vienas brūkšnys žymi vieną cheminį ryšį. Jau žinome, kad vieną cheminį ryšį sudaro viena bendra elektronų pora. Taigi brūkšniais vaizduojamos vandens, anglies dioksido, metano ir vandenilio molekulių formulės atrodys taip (3.8.2 pav.):
Cheminių junginių pavadinimai
Kartu su buityje paplitusiais cheminių medžiagų pavadinimais vartojami tokie, dėl kurių susitaria viso pasaulio chemikai. Žinodami juos galime parašyti medžiagos formulę. Šie pavadinimai apibrėžti tarptautinių taisyklių, kurias nustato Tarptautinė teorinės ir taikomosios chemijos sąjunga (IUPAC). Panagrinėkime, kaip sudaromi kai kurių junginių pavadinimai. Kaip minėjome, nemetalams būdingas didelis elektrinis neigiamumas. Iš nemetalų atomų susidarę neigiamieji jonai vadinami kitaip nei elementai, iš kurių jie gauti. Susipažinkime su kai kuriais neigiamųjų jonų pavadinimais (3.8.1 lentelė).
3.8.1 lentelė. Kai kurių neigiamųjų jonų pavadinimai
Elementas | Simbolis | Neigiamasis jonas | Neigiamojo jono pavadinimas |
Fluoras | F | F– | Fluoridas |
Chloras | Cl | Cl– | Chloridas |
Bromas | Br | Br– | Bromidas |
Jodas | I | I– | Jodidas |
Deguonis | O | O2– | Oksidas |
Siera | S | S2– | Sulfidas |
Azotas | N | N3– | Nitridas |
Fosforas | P | P3– | Fosfidas |
Anglis | C | C4– | Karbidas |
Vandenilis | H | H– | Hidridas |
Kaip matote, šių neigiamųjų jonų pavadinimai skiriasi nuo elementų pavadinimų.
Sudarant junginio pavadinimą taip pat svarbu nurodyti, kiek neigiamųjų jonų yra formulėje. Tai galima padaryti naudojant priešdėlį. Priešdėlių pavadinimai yra nurodyti 3.8.2 lentelėje.
Kai kuriais atvejais neigiamųjų jonų arba elementų, kuriems būdingas didesnis elektrinis neigiamumas, atomų skaičių nurodome priešdėliais.
3.8.2 lentelė. Priešdėliai, naudojami sudarant cheminių junginių pavadinimus
Atomų arba jonų skaičius | Priešdėlis | Pavyzdys | Formulė |
1 | mono- | Anglies monoksidas | CO |
2 | di- | Anglies dioksidas | CO2 |
3 | tri- | Sieros trioksidas | SO3 |
4 | tetra- | Anglies tetrachloridas | CCl4 |
5 | pent- | Divanadžio pentoksidas | V2O5 |
6 | heks- | Sieros heksafluoridas | SF6 |
7 | hept- | Dichloro heptaoksidas | Cl2O7 |
Priešdėliai nurodomi ne visada, tik kai kuriais atvejais. Sudarant junginio pavadinimą pirmiausia nurodomas teigiamasis jonas arba elementas, kurio elektrinis neigiamumas mažesnis. Toliau įvardijamas priešdėlis, kuris rodo neigiamųjų jonų skaičių, ir neigiamojo jono pavadinimas. Pavyzdžiui, junginio, kurio formulė yra SiO2, pavadinimas yra silicio dioksidas. Tačiau junginio Al2O3 pavadinimui priešdėlis netaikomas, šis junginys vadinamas tiesiog aliuminio oksidu.
Jei elementas gali sudaryti kelis junginius su tuo pačiu neigiamuoju jonu, po šio elemento pavadinimo nurodomas jo valentingumas (3.6 temoje nagrinėjome, kaip apskaičiuoti elemento valentingumą). Jis nurodomas skliausteliuose romėnišku skaitmeniu. Geležis gali sudaryti du oksidus. Jų formulės ir pavadinimai yra šie:
FeO – geležies(II) oksidas;
Fe2O3 – geležies(III) oksidas.
Klausimai ir užduotys
- Ką rodo taškinės ir struktūrinės formulės? Kodėl sakoma, kad molekulėje CO2 anglis sudaro 4 ryšius? Kaip tai įrodytumėte?
- Kurios medžiagos dalelės jungiasi kovalentiniu poliniu ryšiu?

- Remdamiesi 3.8.2 paveikslu, taškine formule pavaizduokite metano (CH4) molekulės sandarą.
- Parašykite sieros dioksido cheminę formulę.
- Vandenilio sulfido junginys dvokia supuvusiais kiaušiniais. Parašykite šio junginio molekulinę formulę ir taškinę formulę.
Ko išmokome?
- Vienas cheminis ryšys reiškia vieną bendrą elektronų porą.
- Susidariusi bendra elektronų pora gali būti žymima taškais. Taškais vaizduojamos formulės vadinamos taškinėmis, arba Luiso formulėmis.
- Formulės, kuriose cheminis ryšys vaizduojamas brūkšniu, vadinamos struktūrinėmis.
- Sudarant junginio pavadinimą pirmiausia nurodomas teigiamojo jono arba mažesnio elektrinio neigiamumo elemento pavadinimas. Tada nurodomas elemento valentingumas (jei reikia) ir neigiamojo jono pavadinimas.
- Kai kuriais atvejais neigiamųjų jonų arba elementų, kuriems būdingas didesnis elektrinis neigiamumas, atomų skaičių nurodome priešdėliais.

