Vieninės medžiagos
Priklausomai nuo sandaros, medžiagos skirstomos į vienines ir sudėtines.
Medžiagos, sudarytos iš skirtingų cheminių elementų, vadinamos sudėtinėmis mẽdžiagomis.
Įvairius sudėtinių medžiagų pavyzdžius nagrinėjome 3.5 ir 3.6 temose. Dabar išsamiau aptarkime vienines medžiagas ir jų cheminių formulių sudarymo principus.
Vieninėmis vadinamos medžiagos, sudarytos iš to paties cheminio elemento. To elemento atomai jungiasi kovalentiniais nepoliniais ryšiais.
VIIIA periodo elementai – inertinės dujos – sudaro vienatomes molekules. Šių elementų atomų išorinis elektronų sluoksnis yra užpildytas, todėl inertinės dujos nesijungia nei tarpusavyje, nei su kitomis medžiagomis (kai kurios inertinės dujos gali sudaryti junginius, bet tai – labai reta išimtis). Kitaip yra su kitų grupių elementų vieninėmis medžiagomis.
Žinoma, kad tokių vieninių medžiagų kaip azotas, deguonis ir fluoras molekulės yra sudarytos iš dviejų atomų. Taip yra dėl to, kad šių elementų atomų pavieniai nesuporuoti išorinio elektronų sluoksnio elektronai susijungdami stengiasi sudaryti elektronų poras. Kai vieno elemento atomo išorinis elektronų sluoksnis susilieja su kito atomo išoriniu sluoksniu, abu atomai sudaro bendras elektronų poras. Fluoro molekulėje susidaro viena, deguonies – dvi, o azoto – net trys bendros elektronų poros. Tai priklauso nuo to, kiek elektronų yra atomo išoriniame elektronų sluoksnyje (3.7.1 pav.).
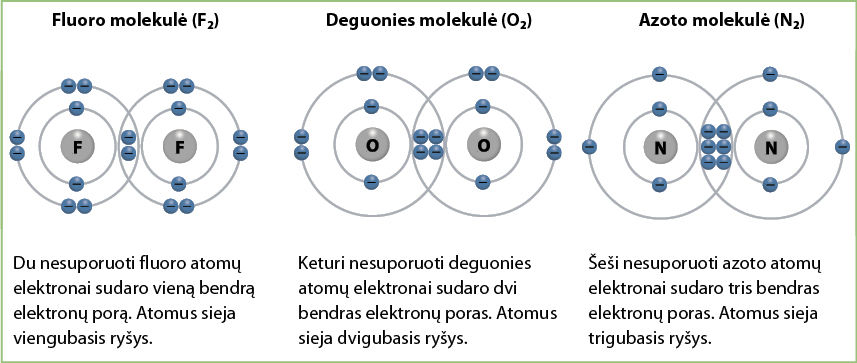
Indeksas 2 ties elementų simboliais rodo, kiek atomų sudaro medžiagos molekulę. Visi šie junginiai yra kovalentiniai nepoliniai.
Dviatomių molekulių yra labai nedaug – svarbesnės jų pateikiamos 3.7.1 lentelėje.
3.7.1 lentelė. Pagrindinės vieninių medžiagų dviatomės molekulės
Vieninė medžiaga | Formulė | Agregatinė būsena kambario temperatūroje |
Vandenilis | H2 | Dujos |
Azotas | N2 | Dujos |
Deguonis | O2 | Dujos |
Fluoras | F2 | Dujos |
Chloras | Cl2 | Dujos |
Bromas | Br2 | Skystis |
Jodas | I2 | Kietoji medžiaga |
Deguonis gali virsti ir kita vienine medžiaga – ozonu (O3). Šios medžiagos molekulė sudaryta iš trijų atomų. Palyginkime deguonies (O2) ir ozono (O3) savybes (3.7.2 lentelė).
3.7.2 lentelė. Deguonies ir ozono savybės
Deguonis | Ozonas |
Molekulės formulė O2 | Molekulės formulė O3 |
Molekulės modelis  | Molekulės modelis  |
Dujos | Dujos |
Bespalvis | Esant didesniam kiekiui – melsvas |
Bekvapis | Aitraus kvapo |
Nenuodingas | Labai nuodingas |
Stabilus | Suskyla |
Kaip matote iš 3.7.2 lentelės, ozono ir deguonies savybės labai skiriasi.
Tai įdomu!
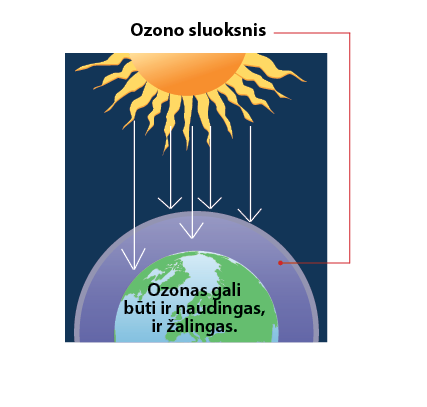
Ozonas susidaro aukštesniuosiuose atmosferos sluoksniuose veikiant ultravioletinei Saulės spinduliuotei ir saugo mus nuo jos žalingo poveikio (3.7.2 pav.). Šis ozono sluoksnis yra labai naudingas. Mokslininkai pastebėjo, kad dalis anksčiau šaldytuvuose ir aerozoliuose naudotų medžiagų gali ardyti ozono sluoksnį, todėl dabar šios medžiagos yra uždraustos. Tačiau ozono gali susidaryti ir žemesniuosiuose atmosferos sluoksniuose dėl išmetamų teršalų. Toks ozonas kenkia gamtai ir žmogui. Ozonas gali būti naudojamas saugant maistą nuo gedimo, dezinfekuojant vandenį ir kitur.
Alotropinės atmainos
Tiek deguonies, tiek ozono molekulės sudarytos iš to paties cheminio elemento – deguonies. Ozonas yra deguonies alotròpinė atmainà.
Vieninės medžiagos, kurios skiriasi savo sandara ir turi skirtingų savybių, vadinamos alotropinėmis atmainomis.
Vieninių medžiagų alotropinių atmainų yra ir daugiau. Geras pavyzdys – anglis. Anglis sudaro net kelias alotropines atmainas. Geriausiai žinomos yra deimantas ir grafitas. Prieš kelis dešimtmečius iš grafito buvo gauta į futbolo kamuolį panaši anglies molekulė C60, kuri pavadinta fulerenù. Palyginkime deimanto, grafito ir fulereno sandarą (3.7.3 pav.).
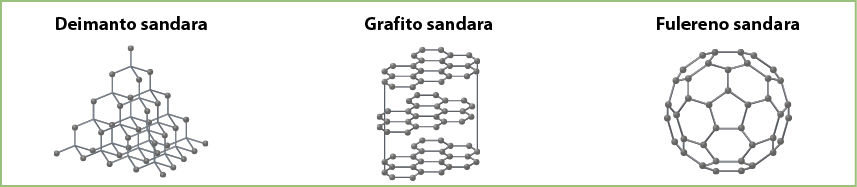
Kaip matyti iš 3.7.3 paveikslo, anglies alotropinės atmainos skiriasi savo sandara. Skirtingos ir jų savybės. Deimantas – pats kiečiausias mineralas, juo lengvai raižomas stiklas, pjaustomas metalas, akmenys ir pan. Skaidrus deimantas – tai brangus briliantas, kuriuo papuoštos daugelio šalių karalių karūnos (3.7.4 pav.). Grafitas yra minkštas, teplus. Deimantas yra nelaidus elektros srovei, o grafitas gerai praleidžia elektros srovę, todėl naudojamas elektrodams gaminti. Neseniai iš grafito gauta nauja alotropinė anglies atmaina – grafenas. Manoma, jog jis gali pakeisti visą elektronikos pramonę. Fulerenas tirpsta kai kuriuose tirpikliuose, o deimantas ir grafitas netirpsta.

Tai įdomu!
Fosforo alotropinės atmainos yra baltasis fosforas (P4) ir raudonasis fosforas, kuris sudarytas iš daug atomų (3.7.5 pav.). Baltasis fosforas yra nuodingas ir ore savaime užsidega, o raudonasis fosforas užsidega tik padegtas. Mišiniu, kuriame yra raudonojo fosforo, dengiami degtukų dėžučių šonai.

Klausimai ir užduotys
- Kas yra vieninės ir sudėtinės medžiagos? Kokiu ryšiu susijungia du to paties elemento atomai?
- Paaiškinkite, kas yra alotropinės atmainos, pateikite pavyzdžių. Kuo skiriasi elemento alotropinės atmainos?
- Paaiškinkite, kuo svarbus ir kuo pavojingas ozonas. Kaip jis susidaro aukštesniuosiuose ir žemesniuosiuose atmosferos sluoksniuose?
- Geltonosios sieros molekulės formulė yra S8. Šios molekulės sandara panaši į karūną ir sudaro uždarą ciklą. Pabandykite pavaizduoti jos molekulę, ryšius tarp sieros atomų žymėdami brūkšniais. Vienas sieros atomas gali sudaryti du ryšius.
- Remdamiesi 3.7.1 paveikslu, pavaizduokite chloro molekulės Cl2 sandarą.
Ko išmokome?
- Vieninėmis vadinamos medžiagos, sudarytos iš to paties cheminio elemento. To elemento atomai jungiasi kovalentiniais nepoliniais ryšiais.
- Vieninės medžiagos, kurios skiriasi savo sandara ir turi skirtingų savybių, vadinamos alotropinėmis atmainomis.
- Ozono sluoksnis saugo Žemę nuo žalingo Saulės spindulių poveikio. Dėl teršalų susidaręs ozonas kenksmingas gamtai ir žmogui.

