Pagrindinės grùpės, péreinamieji elemeñtai, oksidãcijos láipsnis.
Būdingieji – tai daugumai vienos periodinės lentelės grupės elementų pasireiškiantys oksidacijos laipsniai. Pavyzdžiui, visi 15 grupės elementai gali turėti oksidacijos laipsnį +5. Tokio oksidacijos laipsnio šiuos elementus aptinkame oksiduose, rūgštyse, druskose.
Pagrindinių grupių elementų oksidacijos laipsniai
4.3 lentelė. Trečiojo periodo elementų būdingieji oksidacijos laipsniai
Grupės Nr. | 1 | 2 | 13 | 14 | 15 | 16 | 17 |
Elementas | Na | Mg | Al | Si | P | S | Cl* |
Oksidacijos laipsniai | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
Dvinarių junginių formulės |
| HCl–1 |
* Cl, Br ir I dar būdingi oksidacijos laipsniai +3 ir +1; F įgyja tik –1.
** Silicis yra pusmetalis ir įgyja tik +4 oksidacijos laipsnį; vienintelis šios grupės nemetalas yra anglis: C+4O2, C+2O, C–4H4. Šios grupės metalams būdingi oksidacijos laipsniai +4 ir +2.
***Cl2O5 hipotetinis, tik teoriškai numatytas oksidas.
4.3 lentelėje pateikti trečiojo periodo elementų būdingieji oksidacijos laipsniai ir dvinarių junginių formulės. Galime pastebėti tokius dėsningumus.
- Didžiausias oksidacijos laipsnis sutampa su valentinių elektronų skaičiumi. Šis oksidacijos laipsnis pasireiškia, jeigu atomas netenka visų valentinių elektronų (būdinga metalams; susidaro joniniai ryšiai) arba jei visi valentiniai elektronai atitraukiami nuo atomo (būdinga nemetalams; susidaro kovalentiniai ryšiai).
- Nemetalams būdingas dviem vienetais mažesnis už didžiausiąjį oksidacijos laipsnis.
- Nemetalams būdingas aštuoniais vienetais mažesnis už didžiausiąjį oksidacijos laipsnis. Tai neigiamasis oksidacijos laipsnis, kurį nemetalo atomas įgyja prisijungdamas papildomai elektronų ir virsdamas jonu arba patraukdamas savęs link kito nemetalo elektronus ir sudarydamas kovalentinius ryšius.
Kitų periodų pagrindinių grupių elementams su nedidelėmis išimtimis būdingi tokie patys oksidacijos laipsniai. Svarbiausios išimtys susijusios su fluoru ir deguonimi.
- Fluoras yra didžiausio elektrinio neigiamumo elementas, tad joks atomas negali iš jo atimti arba atitraukti elektronų. Fluoro oksidacijos laipsnis junginiuose tik –1.
- Deguonis pagal elektrinį neigiamumą yra antras po fluoro. Tad tik junginiuose su fluoru būna teigiamojo oksidacijos laipsnio (+1 junginyje O2F2 ir +2 junginyje OF2). Jungdamasis su kitais elementais, jis būna neigiamojo oksidacijos laipsnio, dažniausiai –2.
1 pavyzdys
Fosforui būdingi oksidacijos laipsniai +5, +3 ir –3. Paaiškinkite, kaip šie oksidacijos laipsniai susiję su fosforo elektronine sandara, ir pateikite po vieną junginio pavyzdį.
Sprendimas
Fosforo valentinio sluoksnio sandara:
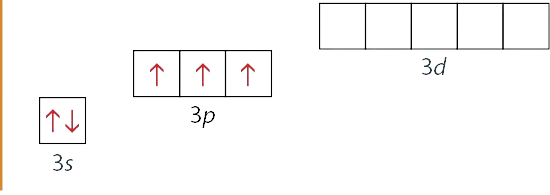
Oksidacijos laipsnis +5 pasireiškia, kai atitraukiami visi penki fosforo valentiniai elektronai, pavyzdžiui,
Oksidacijos laipsnis +3 pasireiškia, kai atitraukiami tik 3p orbitalių elektronai, o 3s elektronai lieka, pavyzdžiui,
Fosforas 3p orbitalėse turi tris nesuporuotus elektronus. Į šias orbitales jis gali pritraukti arba prisijungti papildomus 3 elektronus. Taip susidaro junginys
2 pavyzdys
Parašykite dvinarių anglies ir azoto junginių su deguonimi ir vandeniliu formules.
Sprendimas
Anglis yra 14 grupės elementas, turi 4 valentinius elektronus. Jos būdingieji oksidacijos laipsniai yra +4, +2 ir –4. Teigiamieji oksidacijos laipsniai pasireiškia junginiuose su deguonimi, o neigiamasis – su vandeniliu. Junginių formulės:
CO2; CO; CH4.
Azotas yra 15 grupės elementas, turi 5 valentinius elektronus. Jo būdingieji oksidacijos laipsniai yra +5, +3 ir –3. Teigiamieji oksidacijos laipsniai pasireiškia junginiuose su deguonimi, o neigiamasis – su vandeniliu. Junginių formulės:
N2O5; N2O3; NH3.
Komentaras. Azotas išsiskiria savo oksidacijos laipsnių įvairove. Be taisyklėmis apibrėžtų oksidacijos laipsnių, jam būdingi ir kiti, pavyzdžiui:
Pereinamųjų elementų oksidacijos laipsniai
Pereinamųjų (3–12 grupių) elementų valentiniai elektronai išsidėstę išorinio sluoksnio s ir priešpaskutinio sluoksnio d orbitalėse. Šių elementų oksidacijos laipsnių įvairovė labai didelė (4.4 lentelė). Galime pastebėti, kad 3–7 grupių elementų didžiausias oksidacijos laipsnis, kaip ir pagrindinėse grupėse, sutampa su valentinių elektronų skaičiumi.
4.4 lentelė. Ketvirtojo periodo pereinamųjų elementų oksidacijos laipsniai
Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
+1 | |||||||||
+2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 |
+3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |
+4 | +4 | +4 | +4 | +4 | +4 | +4 | |||
+5 | +5 | +5 | +5 | +5 | |||||
+6 | +6 | +6 | |||||||
+7 |
Pastaba. Dažnesni oksidacijos laipsniai pažymėti žalia spalva.
Klausimai ir užduotys
- Remdamiesi atomų elektronine sandara, paaiškinkite, kodėl visiems 14 grupės elementams būdingas oksidacijos laipsnis +4.
- Arsenas yra 15 grupės elementas. Nurodykite jo būdinguosius oksidacijos laipsnius ir parašykite dvinarių junginių su deguonimi ir vandeniliu formules.
- Bromo elektrinis neigiamumas didesnis už fosforo. Parašykite dviejų fosforo bromidų, kuriuose pasireiškia būdingieji fosforo oksidacijos laipsniai, formules.
- Natrio elektrinis neigiamumas mažesnis už fosforo. Kuris iš fosforo būdingųjų oksidacijos laipsnių pasireikš, jei fosforas sudarys dvinarį junginį su natriu? Parašykite šio junginio formulę.
- 1-ajame pavyzdyje parodytas fosforo valentinių elektronų pasiskirstymas orbitalėse. Žinoma, kad PCl3 molekulėje fosforo atomas yra sp3 hibridizacijos. Sudarykite:
- sp3 hibridizacijos fosforo valentinio sluoksnio orbitalių diagramą;
- PCl3 molekulės erdvinės sandaros brėžinį (prisiminkite anglies sp3 hibridizaciją ir metano molekulės erdvinę sandarą, žr. 3.4 temą).
- Fosforo pentachloridui PCl5 susidaryti reikia, kad fosforo atomas turėtų penkis nesuporuotus elektronus. Dar kartą išnagrinėkite 1 pavyzdyje parodytą fosforo valentinio sluoksnio sandarą ir atsakykite:
- kaip, remiantis hibridizacijos teorija, paaiškinamas penkių kovalentinių ryšių susidarymas PCl5 molekulėje;
- azotas ir fosforas yra 15 grupės elementai. Abu šie elementai sudaro trichloridus PCl3 ir NCl3, o pentachloridą sudaro tik fosforas. Kodėl nėra junginio NCl5?
