
Visa, kas vyksta, susiję su energijos virsmais. Tam, kad galėtume judėti, skaityti, mąstyti, reikalinga energija. Jos gauname su maistu. Bandydami atsekti energijos kelią, galiausiai ateisime iki fotosintezės, kuri vyksta gaunant energijos iš Saulės. Degindami iškastinį kurą savo būstą šildome prieš milijonus metų iš Saulės atkeliavusia energija. Iškastinis kuras – tai „užkonservuota“ Saulės energija. Žemę pasiekiantis Saulės energijos srautas yra tūkstančius kartų didesnis nei žmonija suvartoja. Augalo lapas sunaudoja tik 1–3 % ant jo patenkančios energijos.
Iš smėlio išmokome išgauti silicį, puslaidininkio savybių turintį nemetalą. Silicio monokristalai naudojami kuriant elektrines, kurios Saulės energiją verčia elektra. Jų efektyvumas siekia 15–20 % – tokią dalį jas pasiekusios energijos paverčia elektra.
Cheminės reakcijos irgi susijusios su energijos virsmais. Tai, kas vyksta mėgintuvėlyje, mitochondrijoje, naftos perdirbimo įmonėje, paklūsta energijos tvermės dėsniui, Heso dėsniui.
Išnagrinėję šį skyrių, gebėsite:
- apibūdinti endotermines ir egzotermines chemines reakcijas;
- paaiškinti, kaip reakcijos šiluminis efektas susijęs su cheminių ryšių susidarymu ir nutraukimu;
- apibrėžti, kas yra standartinė junginio susidarymo entalpija;
- taikydami Heso dėsnį apskaičiuoti reakcijos šiluminį efektą;
- palyginti maisto medžiagų energinę vertę.
Cheminių reakcijų šiluminiai efektai
Egzotèrminė reãkcija, endotèrminė reãkcija, enèrgija, enèrgijos tvermės dėsnis, entálpija, standártinis entálpijos pókytis, kinètinė enèrgija, poteñcinė enèrgija, reãkcijos šiluminis efèktas, šilumà, temperatūrà, termochèminė lygtis.
Energijos tvermės dėsnis
Kūrenant laužą mediena reaguoja su ore esančiu deguonimi. Susidaro pelenai ir nematomos dujos – anglies dioksidas ir vanduo:
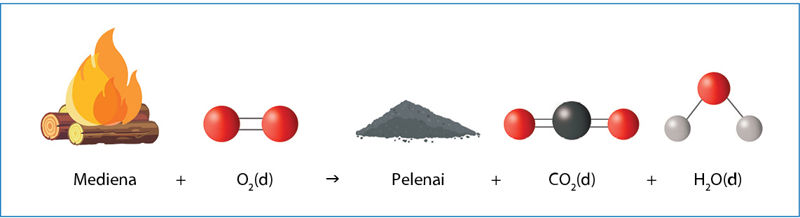
Yra dar vienas šios cheminės reakcijos rezultatas – iš degančio laužo į aplinką šilumos pavidalu sklinda energija.
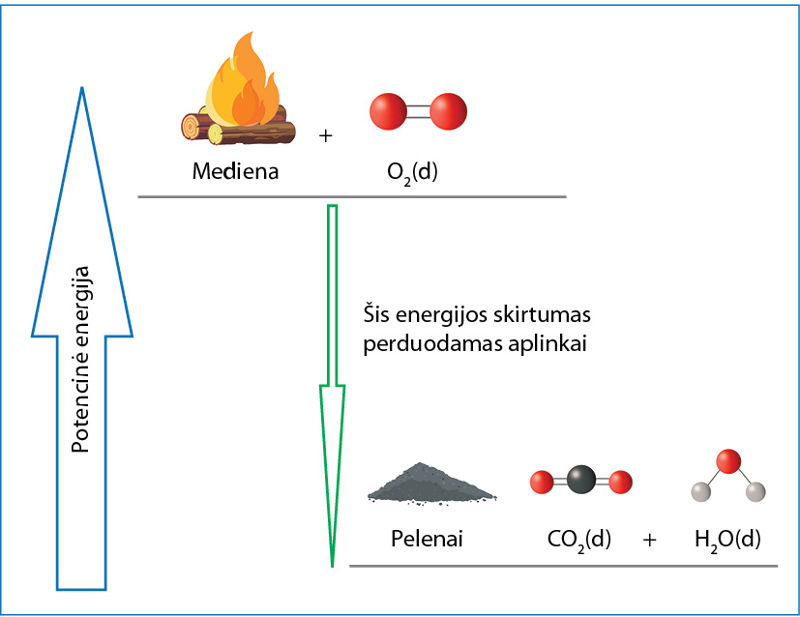
Enèrgijos tvermės dėsnis: energija nei sukuriama, nei sunaikinama. Ji tik iš vienos formos virsta kita.
Pradinės medžiagos (mediena ir deguonis) turėjo tam tikrą kiekį poteñcinės enèrgijos, susijusios su trauka ar stūma tarp molekulių, atomų ir kitų medžiagą sudarančių dalelių. Reakcijos produktai (pelenai, anglies dioksidas ir vanduo) potencinės energijos turi mažiau. Energijos skirtumas niekur nedingo. Jis virto kinètine enèrgija, kuri susijusi su molekulių judėjimu. Aplink laužą esančios oro molekulės ėmė judėti greičiau – tai mes jaučiame kaip padidėjusią temperatūrą (5.1.1 pav.).
Egzoterminės ir endoterminės reakcijos
Reakcija, kuriai vykstant energija šilumos pavidalu išskiriama į aplinką, vadinama egzotèrmine. Jei vykstant reakcijai energija sunaudojama (gaunama) iš aplinkos, tokia reakcija vadinama endotèrmine. Sąvokos „egzoterminis“ ir „endoterminis“ vartojamos ne tik cheminėms reakcijoms nusakyti. Jos tinka visiems kitimams, pavyzdžiui, garavimas yra endoterminis procesas, o kondensacija – egzoterminis. Acetonu valant nagų laką atsiranda šalčio pojūtis. Acetono garavimas yra endoterminis procesas. O štai neatsargiai pakėlę puodo su verdančiu vandeniu dangtį galime stipriai nusitvilkyti – karšti garai kondensuodamiesi išskiria daug energijos ir nudegina.
Temperatūra
Kuo skiriasi šaltas ir karštas vanduo? Karštame vandenyje molekulės juda greičiau. Temperatūrà yra molekulių judėjimo (arba kinetinės) energijos matas. Jei artindami delną prie arbatinuko jaučiate, kad šis yra karštas, vadinasi, jame vandens molekulės juda greitai. Energija šilumos pavidalu perduodama iš ten, kur temperatūra aukštesnė, ten, kur temperatūra žemesnė. Tai vyksta tol, kol temperatūra suvienodėja.
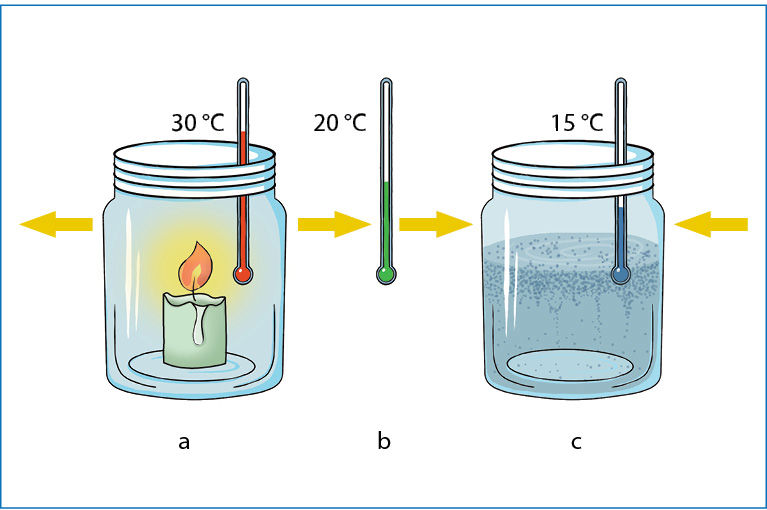
Vykstant egzoterminėms reakcijoms potencinė (ryšių) energija virsta kinetine (judėjimo) energija. Ten, kur vyksta egzoterminė reakcija, pakyla temperatūra. Todėl iš reakcijos zonos (mėgintuvėlio, kolbos ar laužavietės) į aplinką sklinda šiluma (5.1.2 pav., a).
Jeigu reakcija yra endoterminė, reakcijos zonoje molekulių kinetinė (judėjimo) energija virsta potencine (ryšių) energija. Molekulių judėjimui sulėtėjus, reakcijos zona pasidaro šaltesnė už aplinką, todėl šiluma sugeriama iš aplinkos (5.1.2 pav., c).
Temperatūra yra molekulių kinetinės (judėjimo) energijos matas, o šilumà – tai energijos srautas iš šiltesnės vietos į šaltesnę.
Entalpija ir termocheminė lygtis
Visų medžiagoje esančių energijos rūšių sumą vadiname entálpija, kuri žymima H. Tiesa, kiek medžiagoje yra energijos, nežinome. Todėl matuojame tik entalpijos pokyčius ∆H°. Simbolis ∆ rodo, kad tai pokytis, o mažas burbuliukas prie simbolio H° – kad šis pokytis išmatuotas esant 1 baro slėgiui ir 25 °C temperatūrai. Pavyzdžiui, deginant etaną energija išsiskiria. Tai užrašoma termochèmine lygtimi, kurioje nurodoma ne tik kurios medžiagos reaguoja ir susidaro, bet ir koks yra standartinis entalpijos pokytis ∆H°:
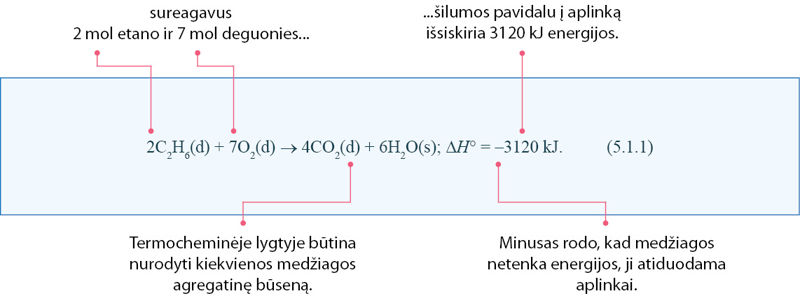
Dydis ∆H° vadinamas reakcijos standártiniu entálpijos pókyčiu. Jeigu nėra kitų energijos perdavimo būdų, šis pokytis sutampa su į aplinką išskiriamu arba iš jos sugeriamu šilumos kiekiu.
1 pavyzdys
Remdamiesi (5.1.1) termochemine lygtimi, apskaičiuokite, kiek šilumos išsiskiria sudeginus 0,145 mol etano.
Sprendimas
Sudarome proporciją:
sudeginus 2 mol etano, išsiskiria 3120 kJ šilumos,
sudeginus 0,145 mol etano, išsiskirs Q kJ šilumos;
Komentaras. Raide Q žymėsime konkrečiu atveju išsiskyrusios arba sunaudotos šilumos kiekį, o ∆H° – šilumos kiekį, kuris išsiskiria arba sunaudojamas reaguojant tokiam medžiagų kiekiui, koks nurodytas reakcijos lygtimi.
2 pavyzdys
Parašykite vieno molio etano degimo termocheminę lygtį.
Sprendimas
(5.1.1) lygtimi parodyta dviejų molių etano degimo reakcija. Mums pagal užduotį tą pačią reakciją rodančią lygtį reikia parašyti kitaip – kad ji rodytų vieno molio etano degimą. Vadinasi, lygtį reikia padalyti iš dviejų:
C2H6(d) + 3,5O2(d) → 2CO2(d) + 3H2O(s);
∆H° = –1560 kJ.
(5.1.2)
Komentaras. Termocheminės lygtys rašomos net ir su trupmeniniais koeficientais (šiuo atveju 3,5 priešais deguonies formulę). Keičiant lygties koeficientus, keičiasi ir reakcijos standartinės entalpijos reikšmė (–3120 / 2 = –1560). Šis reakcijos šiluminį efektą rodantis dydis turi derėti su lygtyje rodomu medžiagų kiekiu.
Klausimai ir užduotys
- Nurodykite, koks procesas vyksta – endoterminis ar egzoterminis ir koks šio proceso standartinis entalpijos pokytis – didesnis ar mažesnis už nulį. Procesai:
- dega žvakė;
- lydosi kaitinamas sviestas;
- kambaryje iš stiklinės lėtai garuoja vanduo;
- delne lydosi (tirpsta) ledo gabaliukas;
- žiemą ežero paviršiuje vanduo stingsta į ledą;
- pilant koncentruotą sieros rūgštį į vandenį, gautas tirpalas labai įkaista;
- atvirame puode verda vanduo (verdančio vandens temperatūra visą laiką lygi 100 °C).
- Kas lemia tirpalo temperatūrą?
- Tirpale esančių jonų krūvis
- Tirpalo spalva
- Tirpalo masė
- Tirpalo dalelių judėjimo greitis
- Ar yra endoterminių arba egzoterminių procesų, kuriems vykstant nekinta medžiagų temperatūra? Atsakymą paaiškinkite.
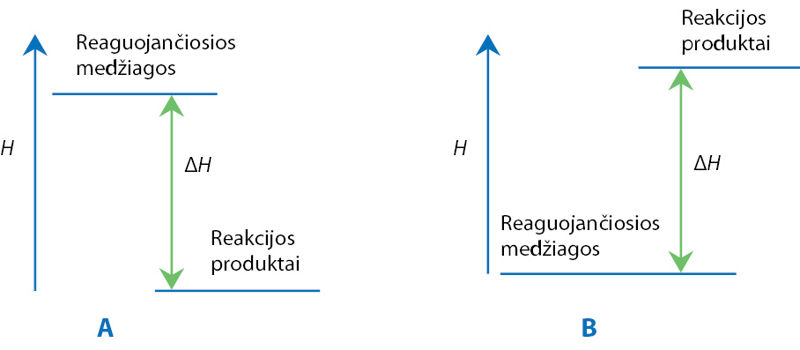
- Kuriuo atveju parodyta endoterminės reakcijos energinė diagrama? Atsakymą paaiškinkite.
- Klasės (t. y. aplinkos) ir joje esančių NaOH(aq) ir HCl(aq) tirpalų temperatūra buvo 21 °C. Į indą su NaOH tirpalu supylus HCl tirpalą, mišinio temperatūra padidėjo iki 23 °C.
- Parašykite įvykusios reakcijos lygtį. Lygtyje nurodykite kiekvienos medžiagos agregatinę būseną.
- Kokio tipo yra įvykusi reakcija pagal skirtingus reakcijų klasifikavimo būdus (nurodykite tris)? Jei primiršote, kokių būna reakcijų, pasikartokite 4.6 temą.
- Kažkas iš mokinių pasakė, kad mišinio temperatūra pakilo, nes mišinys sugėrė energijos iš aplinkos. Pakomentuokite šį teiginį.

