Cheminio ryšio entalpija
Cheminis ryšys – tai trauka tarp medžiagą sudarančių dalelių. Traukai įveikti energiją reikia sunaudoti. Kita vertus, susidarant ryšiui energija išsiskiria. Vienam moliui ryšių1 nutraukti sunaudojama energija vadinama chèminio ryšio entálpija (žr. 4-ąjį priedą).
1 Atkreipkite dėmesį, kad kalbama apie 1 mol ryšių, o ne medžiagų. Pavyzdžiui, 1 molyje metano CH4 yra 4 moliai C–H ryšių, o 1 molyje CO2 yra 2 mol dvigubųjų C=O ryšių.
Pavyzdys
1,00 gramui fluoro F2(d) suskaidyti į atomus sunaudojama 4,10 kJ energijos, o 1,00 g chloro Cl2(d) suskaidyti – 3,44 kJ energijos. Kuris ryšys tvirtesnis: F–F ar Cl–Cl?
Sprendimas
Nepakanka vien pažiūrėti į užduotyje pateiktus skaičius. 1,00 g vienos ir kitos medžiagos turi skirtingą molekulių, o kartu ir ryšių, skaičių. Todėl būtina suvienodinti duomenis. Sudarykime termochemines lygtis, kuriomis būtų parodyta, kiek energijos sunaudojama suardant vieną molį medžiagos, o kartu ir vieną molį kovalentinių ryšių.
Sudarome proporciją:
x = 156 kJ.
Tad 1 mol F–F molekulių, o kartu ir 1 mol ryšių, suskaidyti reikia 156 kJ. F–F ryšio entalpija yra 156 kJ/mol. Tai užrašoma termochemine lygtimi:
F2(d) → 2F(d); ∆H° = 156 kJ.
(5.2.1)
Analogiškai sudaroma chloro skilimo į atomus termocheminė lygtis.
Sudarome proporciją:
γ = 244 kJ.
Termocheminė lygtis:
Cl2(d) → 2Cl(d); ∆H° = 244 kJ.
(5.2.2)
Tad Cl–Cl ryšio entalpija yra 244 kJ/mol.
Atsakymas: tvirtesni cheminiai ryšiai yra Cl2 molekulėje (1 mol Cl–Cl ryšių nutraukti reikia 244 kJ, o 1 mol F–F ryšių – 156 kJ energijos).
Nutraukiant cheminį ryšį energija sunaudojama (tai endoterminis procesas), o susidarant ryšiui energija išsiskiria (tai egzoterminis procesas). Vykstant cheminėms reakcijoms vieni ryšiai nutraukiami, kiti susidaro. Reakcijos šiluminis efektas priklauso nuo to, kiek energijos sunaudojama nutraukiant molekulėse buvusius ryšius ir kiek jos išsiskiria susidarant naujiems ryšiams. Tai panašu į biudžeto (išlaidų ir pajamų) skaičiavimą.
Energijos „išlaidos ir pajamos“
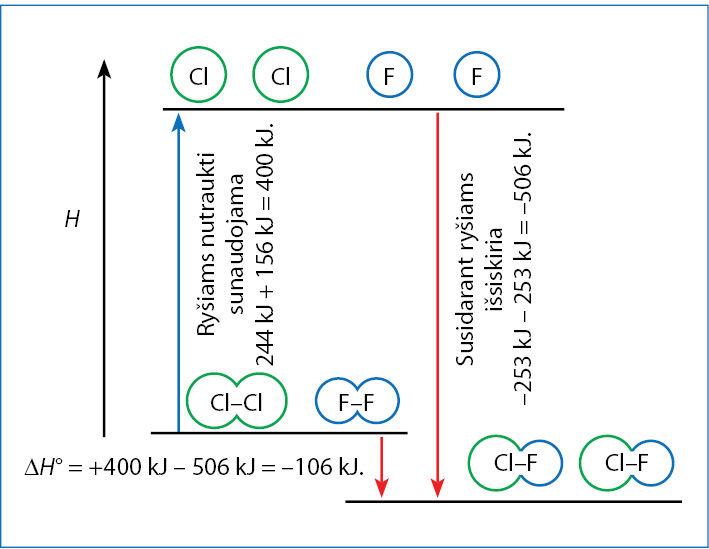
Chloro monofluoridas ClF yra chemiškai labai aktyvios bespalvės dujos. Ši medžiaga susidaro jungiantis Cl2 ir F2 molekulėms.
Cheminio ryšio entalpija:
F–F 156 kJ/mol
Cl–Cl 244 kJ/mol
Cl–F 253 kJ/mol
ClF molekulės ryšiai tvirtesni nei Cl2 ar F2. Tam, kad susidarytų ClF molekulės, pirmiausia reikia nutraukti ryšius Cl2 ir F2 molekulėse. Tam sunaudojama 400 kJ energijos (5.2.1 pav.). Tada atomai susijungia išskirdami 506 kJ energijos. Kadangi išskiriama daugiau energijos, nei jos sunaudojama (susidaro tvirtesni ryšiai), visas suminis procesas yra egzoterminis: +400 kJ – 506 kJ = – 106 kJ. Šis energijos skirtumas atiduodamas aplinkai. Proceso termocheminė lygtis:
Cl2(d) + F2(d) → 2ClF(d); ∆H° = –106 kJ.
(5.2.3)
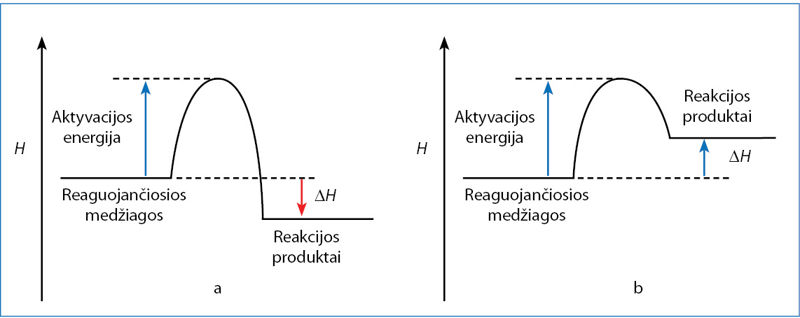
Aktyvacijos energija
Molekulės nuolatos juda ir atsitrenkia viena į kitą. Lėtai judančių molekulių turimos kinetinės energijos nepakanka reakcijai įvykti. Jos po smūgio atšoka viena nuo kitos. Greitai judančios molekulės atsitrenkia viena į kitą taip stipriai, kad smūgio energijos pakanka esamiems ryšiams nutraukti ir reakcijai prasidėti. Reakcijai prasidėti reikalinga energija vadinama aktyvãcijos enèrgija. Reaguoja tik tos molekulės, kurių kinetinė energija lygi arba didesnė už aktyvacijos energiją. Susidarant chloro monofluoridui ClF (5.2.1 pav.), aktyvacijos energija sutampa su ryšiams nutraukti reikalinga energija. Reakcijos energinė diagrama bus išsamesnė, jei joje nurodysime ne tik pradinę ir galutinę medžiagų būseną, bet ir aktyvacijos energiją (5.2.2 pav.).
Klausimai ir užduotys
- Prisiminkite metano chlorinimo reakcijos mechanizmą. Reakcija prasideda metano CH4 ir chloro Cl2 dujų mišinį apšvitinus ultravioletine šviesa. Kodėl šių dujų mišinį reikia apšvitinti ultravioletine šviesa?
- Vienam moliui dujinio azoto N2 molekulių suskaidyti į atomus reikia 946 kJ energijos, o vienam moliui dujinio jodo I2 molekulių – 152 kJ energijos. Šių molekulių taškinės elektroninės formulės:

- Parašykite termochemines lygtis, kuriomis būtų parodytas N2 ir I2 molekulių skilimas į atomus.
- Paaiškinkite, kodėl N2 molekulėms suskaidyti į atomus reikia daug didesnės energijos nei skaidant I2 molekules.
- Azoto dujos chemiškai gana pasyvios. Ore yra ir azoto N2, ir deguonies O2, bet azoto oksidų įprastomis sąlygomis nesusidaro. Kuo galima paaiškinti mažą azoto molekulių reaktyvumą?
- Anglies dioksido skaidymo į atomus termocheminė lygtis yra:
CO2(d) → C(d) + 2O(d); ∆H° = 1598 kJ.
Kam lygi C=O ryšio entalpija?
- Vandenilio bromidą galima susintetinti iš vieninių medžiagų:
H2(d) + Br2(d) → 2HBr(d).
- Kiek ir kokių cheminių ryšių nutrūksta ir kiek naujų susidaro vykstant šiai reakcijai?
- Pasinaudoję gretimoje lentelėje pateikiamais duomenimis, pasakykite, kokia – endoterminė ar egzoterminė – yra ši reakcija.
Medžiaga | Ryšio entalpija, kJ/mol |
H2(d) | 436 |
Br2(d) | 193 |
HBr(d) | 366 |
