Santrauka
Taisyklė OPERA: oksidatorius prisijungia elektronus, reduktorius atiduoda.
Oksidatorius redukuojasi, reduktorius oksiduojasi.
Išvertus iš lotynų kalbos, žodis „reduktorius“ reiškia „mažintojas“ (mažina kito elemento oksidacijos laipsnį).
Lygindami oksidacijos-redukcijos reakcijų lygtis, parenkame dalinių lygčių daugiklius taip, kad atiduotų ir prijungtų elektronų skaičius sutaptų.
Metalai įtampų (aktyvumo) eilėje surikiuoti nuo labiausiai linkusio oksiduotis (aktyviausiai reaguojančio) iki mažiausiai linkusio oksiduotis (neaktyviausio).
Metalas gali išstumti iš junginių metalus, kurie elektrocheminėje metalų įtampų eilėje parašyti į dešinę nuo jo.
Elektrolizė – tai oksidacijos-redukcijos reakcija, kuri vyksta tirpalu arba lydalu tekant nuolatinei elektros srovei.
Prie katodo (neigiamojo elektrodo) vyksta redukcija, prie anodo (teigiamojo elektrodo) vyksta oksidacija.
Aktyviųjų metalų jonus (iki aliuminio imtinai) elektros srove redukuoti įmanoma tik iš lydalų. Kitų metalų jonus galima redukuoti elektrolizuojant tiek lydalus, tiek vandeninius tirpalus.
Prie anodo lengviausiai oksiduojami chlorido, bromido ir jodido jonai.
Jei tirpale yra deguoninių rūgščių liekanų, prie anodo oksiduojamas vanduo, susidaro deguonies dujos ir vandenilio jonai.
Korozija – tai metalo reakcija su aplinkos medžiagomis (deguonimi, vandeniu, rūgštiniais oksidais).
Praktinės užduotys
1. Metalų reakcija su druskos rūgštimi
Reikės
Keturių mėgintuvėlių, 1 mol/l druskos rūgšties tirpalo, magnio, aliuminio, geležies ir vario.
Tyrimo žingsniai ir išvados
- Į keturis mėgintuvėlius įpilkite po 5 ml 1 mol/dm3 druskos rūgšties HCl tirpalo. Į vieną mėgintuvėlį įdėkite gabaliuką vario, į kitą – geležies, į trečią – aliuminio, į ketvirtą – magnio.
- Stebėkite ir aprašykite vykstančius reiškinius. Nurodykite, kuriame mėgintuvėlyje reakcija vyksta sparčiausiai. Ar kinta reakcijos greitis?
- Parašykite reakcijų bendrąsias ir sutrumpintąsias jonines lygtis. Lygtyse nurodykite kiekvienos medžiagos agregatinę būseną.
- Susiekite reakcijos greitį su metalo padėtimi įtampų eilėje. Ar visais atvejais aktyvesnis metalas reaguoja didesniu greičiu? Jei pastebėjote kokių nors neatitikimų, paaiškinkite juos.
2. Metalo reakcija su druskų tirpalais
Reikės
Dviejų mėgintuvėlių, sidabro nitrato tirpalo, cinko sulfato tirpalo, dviejų gabaliukų vario.
Tyrimo žingsniai ir išvados
- Į vieną mėgintuvėlį įpilkite apie 5 ml sidabro nitrato, į kitą – tiek pat cinko sulfato tirpalo. Į abu mėgintuvėlius įmeskite po gabaliuką vario.
- Stebėkite ir aprašykite vykstančius reiškinius. Susiekite stebimus reiškinius su metalų padėtimi įtampų eilėje.
- Jei vyko cheminė reakcija, parašykite bendrąją ir sutrumpintąją joninę lygtį, nurodykite kiekvienos medžiagos agregatinę būseną.
3. Elektrolizė
Reikės
Nuolatinės elektros srovės šaltinio arba baterijos, jungiamųjų laidų, dviejų grafitinių strypelių arba dviejų iš abiejų galų padrožtų pieštukų, universaliojo indikatoriaus popierėlio, natrio sulfato tirpalo, Petri lėkštelės.
Tyrimo žingsniai ir išvados
- Į Petri lėkštelę įdėkite universaliojo indikatoriaus popierėlį ir sudrėkinkite jį natrio sulfato tirpalu. Prie elektros srovės šaltinio prijunkite laidus ir grafitinius strypelius (panašiai kaip parodyta 7.4.1 paveiksle. Prilieskite grafitinius strypelius prie sudrėkinto universaliojo popierėlio ir stebėkite pokyčius.
- Kaip pasikeitė indikatoriaus spalva prie vieno ir kaip – prie kito elektrodo? Paaiškinkite spalvų pokyčius, parašykite dalines elektrolizės lygtis.
Papildomos užduotys
- Išlyginkite oksidacijos-redukcijos lygtis. Nurodykite oksidatorių ir reduktorių.
- Fe2O3(k) + CO(d) → Fe(k) + CO2(d);
- Al(k) + H2SO4(aq) → Al2(SO4)3(aq) + H2(d);
- KNO2(aq) + KClO3(aq) → KNO3(aq) + KCl(aq);
- SO2(d) + KClO3(aq) + H2O(s) → H2SO4(aq) + KCl(aq);
- H2S(aq) + HNO3(aq) → S(k) + NO2(d) + H2O(s);
- H2S(aq) + HNO3(aq) → S(k) + NO(d) + H2O(s);
- KMnO4(aq) + KCl(aq) + H2SO4(aq) → MnSO4(aq) + K2SO4(aq) + Cl2(d) + H2O(s);
- KMnO4(aq) + HCl(aq) → MnCl2(aq) + KCl(aq) + Cl2(d) + H2O(s);
- KI(aq) + KIO3(aq) + H2SO4(aq) → I2(k) + K2SO4(aq) + H2O(s);
- Cl2(d) + NaOH(aq) → NaCl(aq) + NaClO3(aq) + H2O(s);
- HCHO(aq) + Ag2O(amoniakinis) → CO2(d) + Ag(k);
- Fe3O4(k) + CO(d) → Fe(k) + CO2(d);
- KMnO4(aq) + CH3OH(aq) + H2SO4(aq) → K2SO4(aq) + MnSO4(aq) + CH3COOH(aq) + H2O(s);
- KMnO4(aq) + H2O2(aq) + H2SO4(aq) → K2SO4(aq) + MnSO4(aq) + O2(d) + H2O(s);
- K2Cr2O7(aq) + KCl(aq) + HNO3(aq) → KNO3(aq) + Cr(NO3)3(aq) + Cl2(d) + H2O(s);
- K2Cr2O7(aq) + KCl(aq) + H2O(s) → KOH(aq) + Cr(OH)3(k) + Cl2(d).
- Išnagrinėkite šią kalio chlorato reakciją:
KClO3(k) → KCl(k) + O2(d).- Parašykite oksidacijos ir redukcijos dalines lygtis, išlyginkite lygtį.
- Apskaičiuokite reakcijos standartinę entalpiją. Nurodykite, kokia tai reakcija pagal šiluminį efektą.
- Cheminės reakcijos klasifikuojamos pagal įvairius požymius. Kokiai reakcijų grupei priskirtina ši reakcija pagal tai, kad iš vienos medžiagos susidaro dvi?
- Tam tikromis sąlygomis iš nitrato jonų susidaro amonio jonai
NH 4 + - Apskaičiuokite azoto oksidacijos laipsnį viename ir kitame jone, parašykite išlygintą dalinę lygtį, kuria būtų parodytas azoto oksidacijos laipsnio kitimas.
- Koks procesas vyksta, kai nitratas virsta amonio jonu – oksidacija ar redukcija?
- Į kalio jodido KI ir krakmolo tirpalą leidžiant chloro dujas, tirpalas įgyja tamsiai mėlyną spalvą. Paaiškinkite, kodėl.
- Parašykite ir išlyginkite lygtis reakcijų, kurios vyksta gyvsidabrį paveikus:
- koncentruota azoto rūgštimi;
- praskiesta azoto rūgštimi.
- Palyginti su kitomis joninėmis medžiagomis, švino(II) bromidas lydosi gana neaukštoje temperatūroje, maždaug 370 °C. Parašykite dalines ir suminę lygtį, kuriomis būtų parodyta, kas vyksta elektrolizuojant išlydytą švino(II) bromidą.
- Dvi vienodos geležinės vinys nušveistos švitriniu popieriumi ir nuplautos vandeniu. Viena jų panardinta į koncentruotą azoto rūgštį ir palaikyta, tada vėl nuplauta vandeniu. Abi vinys pamerktos į sidabro nitrato tirpalą. Ar abi vinys vienodai reaguos su sidabro nitratu? Atsakymą paaiškinkite.
- Azoto rūgštis vadinama koncentruota, jei jos koncentracija viršija 30 %, arba 6 mol/l. Jei šios medžiagos masės dalis tirpale viršija maždaug 80 %, rūgštis vadinama rūkstančia, mat ji lėtai skyla, išskirdama rudas NO2 dujas:
HNO3(s) → H2O(s) + O2(d) +NO2(d).
Skilimą paspartina priemaišos ir Saulės šviesa.- Išlyginkite azoto rūgšties skilimo reakcijos lygtį. Nurodykite, kas šiuo atveju yra oksidatorius ir kas – reduktorius.
- Kokios reakcijos vadinamos skilimo? Ar visos skilimo reakcijos yra ir oksidacijos-redukcijos (atsakymą pagrįskite, parašydami reakcijos lygčių pavyzdžių)?
- Apskaičiuokite reakcijos standartinės entalpijos pokytį. Laikykite, kad azoto rūgštis yra gryna skysta medžiaga.
- Vykstant elektrolizei išsiskiriančias dujas paprasčiausia surinkti taip: mėgintuvėliai pripilami elektrolizuojamojo tirpalo, uždengiami, apverčiami ir užvožiami ant elektrodų (1 pav.). Elektrolizuojant natrio sulfato vandeninį tirpalą, abiejuose mėgintuvėliuose susikaupė dujų.
- Kokios dujos 1 paveiksle pažymėtos raide A, o kokios – B?
- Elektros srovės šaltinio poliai 1 paveiksle pažymėti raidėmis C ir D. Kuri raidė žymi teigiamąjį polių?
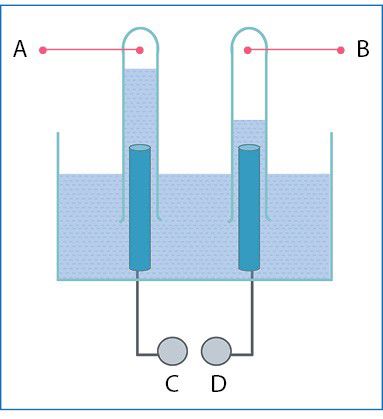
- 0,20 kg tirpalo, kuriame natrio chlorido masės dalis 5,0 %, elektrolizuota tol, kol neliko chlorido jonų. Apskaičiuokite:
- išsiskyrusio chloro masę;
- išsiskyrusio vandenilio masę;
- natrio hidroksido procentinę koncentraciją tirpale po elektrolizės.
- Fluoras F2 gaunamas elektrolizuojant bevandenį vandenilio fluorido HF ir kalio fluorido KF mišinį.
- Paaiškinkite, kodėl fluoro dujoms gauti netinka vandeninis tirpalas.
- Nurodykite, kokiems elektrolitams pagal stiprumą priskiriamas vandenilio fluoridas ir kokiems – kalio fluoridas.
- Paaiškinkite, kodėl elektrolizuojamas ne grynas vandenilio fluoridas, o mišinys su kalio fluoridu (užuomina: atkreipkite dėmesį į b) dalies atsakymus).
- Vienas aptariamos elektrolizės produktas yra fluoro dujos. O koks kitas produktas?
- Elektrolizuojant nikelio(II) sulfato vandeninį tirpalą, prie grafitinio anodo skiriasi deguonies dujos, o prie katodo ne tik redukuojami nikelio jonai, bet ir skiriasi vandenilio dujos. Taip nutinka, kai elektrolizuojami vidutinio aktyvumo metalų junginių tirpalai. Prie anodo išsiskyrė 0,0500 mol deguonies, o prie katodo – 0,0030 mol vandenilio dujų. Apskaičiuokite prie katodo redukuoto nikelio masę.
- Į 0,30 kg tirpalo, kuriame vario(II) sulfato procentinė koncentracija 6,0 %, panardinti grafitiniai strypeliai ir kurį laiką leista nuolatinė elektros srovė (žr. (7.5.10) lygtį). Prie vieno iš elektrodų išsiskyrė 0,040 mol deguonies dujų.
- Kiek gramų vario išsiskyrė prie kito elektrodo?
- Kokia yra tirpalo masė baigus elektrolizuoti?
- Apskaičiuokite sieros rūgšties procentinę koncentraciją baigus elektrolizuoti.
- Kurio metalo danga tinka plieninei skardai nuo korozijos apsaugoti?
- Nikelio
- Cinko
- Vario
- Švino
- Kuri formulė tiksliausiai rodo rūdžių sudėtį?
- Fe(OH)2
- FeO · xH2O
- Fe(OH)2 · xH2O
- Fe2O3 · xH2O
- Kai vyksta metalo korozija, metalas:
- Netenka elektronų
- Prisijungia elektronų
- Metalų korozija ne visada yra nepageidaujamas reiškinys. Lauke esančias varines ar vario lydinių skulptūras su laiku padengia melsvai žalsvos apnašos – patina. Susidariusios apnašos yra kompaktiškos, neardo skulptūrų ir netgi saugo jas nuo tolesnės korozijos. Be to, estetinio vaizdo šie korozijos produktai taip pat negadina.
Ištyrus patinos mėginį nustatyta, kad jos sudėtis masės procentais yra: 57,48 % vario, 36,18 % deguonies, 5,43 % anglies ir 0,91 % vandenilio.- Sudarykite patinos empirinę formulę.
- Kokios ore esančios medžiagos reaguoja susidarant patinai?
- Nurodykite, kokių jonų yra patinoje, jei, jos mėginį paveikus rūgštimi, išsiskiria baltas nuosėdas su kalkių vandeniu sudarančios dujos.
- Cheminius elektros srovės šaltinius vadiname baterijomis. Jose vyksta savaiminė oksidacijos-redukcijos reakcija. Baterijos ir elektrolizeriai yra vienas kitam priešingi įrenginiai. Baterijoje vyksta savaiminė oksidacijos-redukcijos reakcija, baterija yra elektros srovės šaltinis. Elektrolizeryje vyksta priverstinė oksidacijos-redukcijos reakcija. Elektrolizeris yra elektros srovės vartotojas.
Išmaniuosiuose telefonuose ir kituose nešiojamuosiuose prietaisuose dažniausiai naudojamos ličio jonų baterijos. Prietaisui veikti reikalingus elektronus generuoja litis. Vyksta (1) reakcija:
Li(k) → Li+ + e–. (1)
Elektronai juda elektros grandine, aprūpina energija veikiantį telefoną ir atkeliauja iki kito elektrodo, kur vyksta (2) reakcija:
CoO2(k) + e– + Li+ → LiCoO2(k). (2)
- Pateiktos (1) ir (2) lygtys yra dalinės. Sudarykite suminę ličio jonų baterijoje vykstančios reakcijos lygtį.
- Pateiktose (1) ir (2) lygtyse ličio jonų agregatinė būsena nenurodyta. Ličio jonų baterijose naudojami organiniai tirpikliai. Paaiškinkite, kodėl ličio jonų baterijoje tirpikliu negali būti vanduo.
- Veikiant baterijai vyksta savaiminė oksidacijos-redukcijos reakcija. Iškrautą bateriją prijungiame įkrauti. Baterijos įkrovimo procesas yra elektrolizė. Išorinis elektros srovės šaltinis tiekia energiją ir priverčia visas pirmiau aptartas reakcijas vykti priešinga kryptimi. Vadinasi, elektrolizė vyksta kiekvieną kartą, kai įkraunate savo nešiojamąjį kompiuterį ar telefoną. Parašykite reakcijos, kuri vyksta įkraunant ličio jonų bateriją, suminę lygtį.
