Metalų korozija
Dauguma metalų reaguoja su aplinkoje esančiomis medžiagomis ir palaipsniui ỹra, virsta junginiais. Tai vadinama metãlų koròzija (lot. corrodo – „sugraužti“). Iš visų metalų daugiausia išgaunama geležies. Tai viena svarbiausių konstrukcinių medžiagų. Deja, geležis neatspari korozijai. Geležies korozijos produktų – rūdžių – susidarymą apytiksliai atspindi tokia oksidacijos-redukcijos reakcija:
4Fe(k) + 3O2(d) + xH2O(s) → 2Fe2O3 · xH2O(k).
(7.7.1)
Rūdžių Fe2O3 · xH2O(k) tankis gerokai mažesnis už geležies, t. y. rūdys užima daugiau vietos nei geležis. Todėl rūdijimo pažeista vieta išsipučia, trūkinėja, tampa akyta (7.7.1 pav.). Pro tokią akytą medžiagą lengvai prasiskverbia drėgmė, deguonis, teršalai, tad koroduoja naujos geležies porcijos.

Visai kitaip koroduoja aliuminis. Nors tai labai aktyvus metalas, kuris gana sparčiai reaguoja su deguonimi, tačiau jo oksidas yra didelio tankio. Susidariusi oksido plėvelė išlieka vientisa. Pro ją aplinkos medžiagos neprasiskverbia. Tad ši plėvelė apsaugo aliuminį nuo tolesnės korozijos. Anksčiau naudotos aliumininės lietuviškų 1, 2 ir 5 centų monetos neblizga. Įbrėžus kietesniu daiktu, matyti blizgantis pėdsakas. Tai atsivėręs neoksiduotas aliuminis. Jis blizgus, kaip ir visi metalai. Bet po kelių dienų įbrėžimo vieta papilkėja, nes susidaro neblizgus aliuminio oksidas. Švinas irgi visada atrodo neblizgus, kol jo neįbrėžiame.
Korozijos etapai
Rūdžių Fe2O3 · xH2O(k) susidaro geležiai reaguojant su deguonimi ir vandeniu. Šią oksidacijos-redukcijos reakciją sudaro keli etapai.
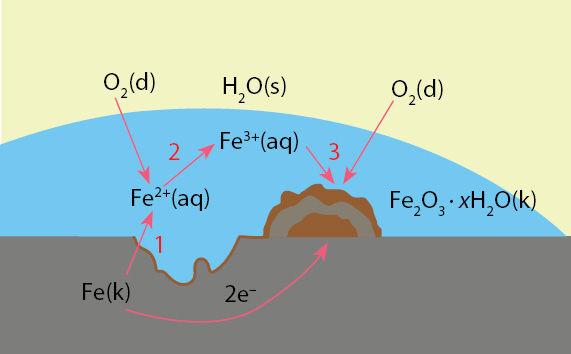
Geležies atomai oksiduojami. Į tirpalą patenka Fe2+ jonai, metale atsiranda išgrauža (7.7.2 paveikslo 1 vieta).
Fe(k) – 2e– → Fe2+(aq).
Tirpale Fe2+ jonus oksiduoja ištirpęs dideguonis (7.7.2 paveikslo 2 vieta).
Fe2+(aq) – 1e– → Fe3+(aq).
Dalis vandenyje ištirpusio deguonies oksiduoja Fe2+ jonus, susidaro Fe3+ jonai (7.7.2 paveikslo 2 vieta). Kita ištirpusio deguonies dalis prisijungia elektronus, kurių neteko geležies atomai. Kadangi elektronai metale juda laisvai, deguonies ir elektronų sąveika gali vykti nebūtinai ten, kur susidarė išgrauža (7.7.2 paveikslo 3 vieta). Dėl šios sąveikos susidaro hidroksido jonų:
O2(aq) + 2H2O(s) + 4e– → 4OH–(aq).
Parinkę tinkamus daugiklius ir sudėję oksidacijos bei redukcijos dalines lygtis, gauname:
Suprastinę nepakitusias daleles, gauname:
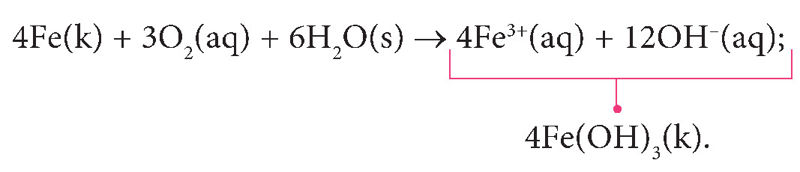
Geležies(III) hidroksidas palaipsniui skyla į oksidą Fe2O3 ir vandenį, susidaro rūdys Fe2O3 · xH2O(k).
Jonai spartina koroziją
Korozijos reakcijos susijusios su krūvį turinčių dalelių judėjimu (jonų – tirpale, elektronų metale). Kuo tirpale daugiau jonų, tuo jo elektrinis laidumas didesnis ir korozijos reakcijos vyksta sparčiau. Koroziją ypač spartina vandenilio H+ ir chlorido Cl– jonai, šiek tiek mažesnę įtaką daro nitrato ir sulfato jonai. Chlorido jonai ardo metalus pasyvinančius sluoksnius.
Vandenilio jonų atsiranda vandenyje tirpstant rūgštiniams oksidams. Šiek tiek prie to prisideda ore esantis anglies dioksidas. Dar labiau koroziją spartina stipresnes rūgštis sudarantys sieros ir azoto oksidai. Iškastiniame kure esama sieros priemaišų. Deginamas toks kuras tampa sieros oksidų šaltiniu. Taršiausias iškastinis kuras – akmens anglys. Automobilių varikliuose dėl didelio slėgio ir aukštos temperatūros šiek tiek azoto susijungia su deguonimi, susidaro azoto oksidų. Ypač daug jų išsiskiria dyzeliniuose varikliuose.
Nepamirškime ir temperatūros. Kuo aukštesnė temperatūra, tuo visos reakcijos vyksta sparčiau. Tad ir korozija spartėja keliant temperatūrą.
Nuostoliai dėl korozijos
Viso pasaulio ekonominiai nuostoliai dėl korozijos sudaro kelis trilijonus eurų. Tai sudaro apie 3–4 % viso pasaulio bendrojo vidaus produkto. Į šią sumą įskaičiuoti tik tiesioginiai korozijos nuostoliai. Laiku nepastebėjus ir nepašalinus korozijos pažeisto vamzdžio, tilto atramų, transporto priemonių detalių, gali įvykti avarijos, žūti žmonių. Su tokiais įvykiais susiję nuostoliai į pirmiau nurodytus rodiklius neįskaičiuoti.
Korozijos prevencija
Korozija – tai metalo reakcija su aplinkos medžiagomis. Todėl, siekiant išvengti korozijos, reikia apsaugoti metalą nuo sąlyčio su aplinka. Tam naudojama danga. Metalai dažomi, padengiami plastiko, tepalo sluoksniu.
Kai kurie lydiniai yra atsparesni korozijai nei grynas metalas. Metalo atsparumą korozijai galima padidinti jį lydant su kitais metalais. Pagrindinis nerūdijančio plieno priedas – chromas. Jo nerūdijančiame pliene būna 12 % ir daugiau.
Vieną metalą galima padengti kito metalo sluoksniu. Esant dviejų metalų sąlyčiui, aktyvesnis jų koroduoja greičiau. Pavyzdžiui, esant geležies ir vario sąlyčiui, geležies korozija vyks sparčiau, o esant geležies ir aktyvesnio cinko sąlyčiui – lėčiau. Todėl geležinės sijos, vamzdžiai, skarda cinkuojami. Net nebūtina apsauginiu metalo sluoksniu dengti visą geležinį gaminį. Pakanka prie saugotinos geležinės konstrukcijos pritvirtinti aktyvesnio metalo, pavyzdžiui, magnio, plokštes. Vėliau korozijos sunaikintos plokštės pakeičiamos naujomis. Taip saugomi laivų korpusai, požeminiai vamzdžiai ir kitos didelės konstrukcijos (7.7.3 pav.).

Pasyvesnis metalas, pavyzdžiui, varis, geležį apsaugotų nuo korozijos tik tuo atveju, jei visa geležinė detalė būtų padengta vientisu vario sluoksniu. Bet, atsiradus bent mažiausiam dangos pažeidimui, geležis pradėtų sąveikauti su aplinka ir koroduotų greičiau negu nepadengta variu.
Klausimai ir užduotys
- Geležinės konstrukcijos dažomos. Vienas iš tikslų – geresnis estetinis vaizdas. Kokios dar naudos teikia dažymas? Kas atsitinka pažeidus dažų sluoksnį?
- Geležinė detalė padengiama ištisiniu sidabro sluoksniu. Ar šis sluoksnis apsaugos geležį nuo rūdijimo? Kas atsitiks pažeidus sidabro dangą (įbrėžus tiek, kad įbrėžimo vietoje atsivers geležis)?
- Nerūdijantis plienas yra geležies lydinys, kurio vienas iš būtinų komponentų yra chromas. Tokio lydinio paviršiuje susidaro apsauginis chromo oksidų sluoksnis. Įbrėžtas, toks lydinys vėl oksiduojasi. Taip atkuriamas apsauginis sluoksnis. Vieno nerūdijančio plieno sudėtis masės procentais yra: 72,2 % geležies, 20,2 % chromo ir 7,6 % nikelio. Apskaičiuokite šio lydinio sudėtį, išreikštą metalų molių santykiu.
