Vandenilinis ryšys
Joniniai ir kovalentiniai ryšiai yra stiprūs. Jiems suardyti reikia papildomos energijos. Tačiau ryšiai tarp molekulių – tarpmolekuliniai ryšiai – gali būti kur kas silpnesni. Nors tokius ryšius nesunku suardyti, be jų neįmanoma baltymų, nukleorūgščių ir kitų gyvybei svarbių molekulių sandara.
Tarpmolekuliniai ryšiai susidaro tarp atskirų molekulių. Tarp didelės molekulės atskirų atomų gali susidaryti silpni ryšiai, kurie yra panašūs į tarpmolekulinius ryšius tarp atskirų molekulių.
Išsamiau panagrinėkime vieną svarbesnių tarpmolekulinių ryšių – vandenilinį.
Vandenilinis ryšỹs susiformuoja tarp kovalentinį polinį ryšį sudariusio ir dalinį teigiamąjį krūvį įgijusio vandenilio atomo (pavyzdžiui, vandenilio atomo vandens molekulėje) ir kitos molekulės neigiamąjį polių turinčio atomo (deguonies, azoto, fluoro ir kt.). Vandenilinis ryšys gali susidaryti ir tarp vienos didelės molekulės atomų.
3.2.7 paveiksle pavaizduota vandens molekulė, kurią sudaro du vandenilio atomai ir vienas deguonies atomas. Kaip jau minėta, jų elektrinio neigiamumo skirtumas yra 1,22. Tai reiškia, kad deguonis, kuriam būdingas didesnis elektrinis neigiamumas, traukia vandenilio elektronus. Todėl vandens molekulė tampa dipoliù, t. y. joje yra du poliai – neigiamasis ir teigiamasis. Deguonies atomas yra neigiamasis vandens molekulės polius, o vandenilio atomai – teigiamasis (3.3.1 pav.).
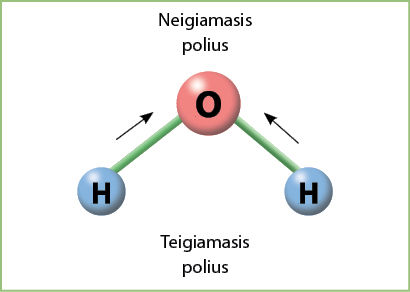
Dėl šios priežasties vandens molekulės gali sąveikauti viena su kita. Teigiamasis vienos molekulės galas (vandenilio atomas) silpnu ryšiu susijungia su kitos vandens molekulės neigiamuoju galu (deguonies atomu) – taip susidaro vadinamasis vandenilinis ryšys. Todėl net kelios vandens molekulės sudaro bendrą darinį (3.3.2 pav.). Susidarius tarpmolekuliniam ryšiui, pakinta junginių savybės. Pavyzdžiui, vandens virimo temperatūra aukštesnė, palyginti su kitų medžiagų, kurios sudarytos iš panašaus dydžio molekulių.
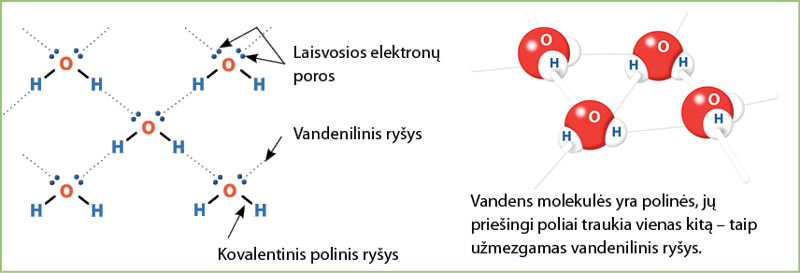
Nustatyta, kad atstumas tarp atskirų vandens molekulių yra dvigubai didesnis nei atstumas tarp deguonies ir vandenilio atomo. Nepaisant to, net esant silpnai molekulių sąveikai, išlaikomas bendras susijungusių molekulių darinys.
Vandenilinis ryšys susidaro ne tik tarp vandenilio ir deguonies. Jis gali susidaryti tarp vienos molekulės vandenilio ir, pavyzdžiui, azoto arba kito atomo, kuriam būdingas didelis elektrinis neigiamumas. Vandenilinis ryšys ypač svarbus baltymų molekulėse. Jis padeda išlaikyti sudėtingą baltymų sandarą. Vandenilinis ryšys gana nesunkiai suardomas, pavyzdžiui, padidinus temperatūrą. Verdant arba kepant kiaušinį, vandenyje tirpus baltymas tampa netirpus, nes atskirų baltymo molekulės dalių ryšiai suyra ir baltymas nebetirpsta (3.3.3 pav.).
Kaip žinome, visa gyvųjų organizmų paveldima informacija saugoma nukleorūgščių. DNR (deoksiribonukleorūgšties) molekulės, iš kurios atkarpų sudaryti genai, sandarą palaiko vandeniliniai ryšiai (3.3.4 pav.).

Kiti tarpmolekuliniai ryšiai
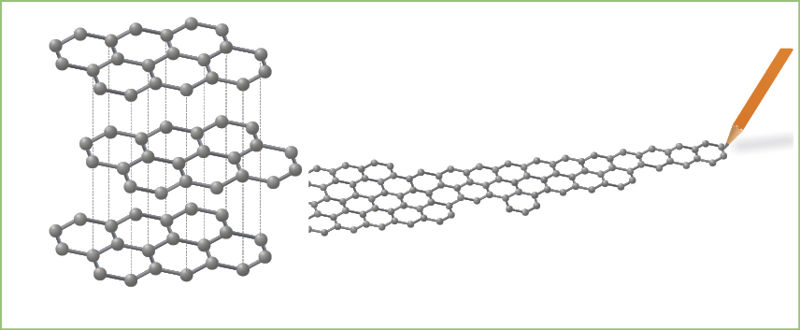
Tarp molekulių gali susidaryti ir kitokių silpnų ryšių. Vienas geriausių pavyzdžių – grafito sluoksnių tarpmolekulinis ryšys. Grafitas sudarytas iš anglies atomų, kurie sujungti kovalentiniais nepoliniais ryšiais. Šie anglies atomai yra išsidėstę sluoksniais, kurių tarpusavio sąveika labai silpna. Brėžiant pieštuku ant popieriaus lapo, grafito anglies sluoksniai atsiskiria vienas nuo kito (3.3.5 pav.).
Atlikime bandymą ir panagrinėkime tarpmolekulinę jodo ir krakmolo sąveiką.
Tyrimas
Jodo ir krakmolo sąveika
Darbo tikslas: ištirti jodo sąveiką su krakmolo tirpalu.
Jums reikės:
- žiupsnelio krakmolo;
- lašo spiritinio jodo tirpalo;
- mėgintuvėlio;
- mėgintuvėlio laikiklio;
- 1–2 ml vandens;
- lazdelės maišyti;
- kaitlentės arba degiklio.
Darbo eiga:
- Mėgintuvėlį įdėkite į laikiklį.
- Į mėgintuvėlį įlašinkite šalto vandens ir ten pat įberkite žiupsnelį krakmolo.
- Gerai išmaišykite susidariusį mišinį.
- Nuolat maišydami atsargiai šildykite mišinį virš kaitlentės arba degiklio liepsnos.
- Kai krakmolas ištirps ir taps kleisteriu (skaidriu, tirštu ir lipniu tirpalu), ataušinkite.
- Į ataušusį kleisterį įlašinkite lašą spiritinio jodo tirpalo. Stebėkite jodo spalvos pokytį.
- Pakaitinkite gautą spalvotą mišinį dar kartą. Stebėkite spalvos pokytį.
- Ataušinkite kleisterio ir jodo mišinį. Stebėkite, kaip kinta spalva.
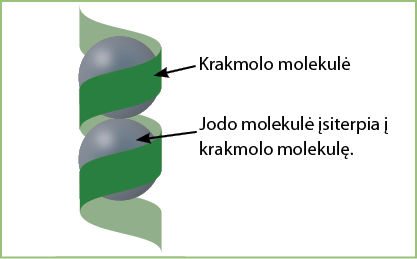
Paaiškinimas. Jodo molekulė sudaryta iš dviejų jodo atomų ir yra žymima I2. Jodo molekulė įsiterpia į krakmolo molekulę, kuri yra spiralės formos, todėl jodo spalva pakinta (3.3.6 pav.). Kai mišinys pakaitinamas, jodo molekulės ir krakmolo ryšys susilpnėja, todėl spalvos nebematome. Ataušinus mišinį jodas vėl susijungia su krakmolu. Tarp šių dviejų medžiagų susidaro tarpmolekulinis ryšys. Tai nėra tikrasis junginys, todėl pakaitinus ryšys silpnėja, ataušinus vėl susidaro.
Klausimai ir užduotys
- Kas yra tarpmolekuliniai ryšiai? Kuo jie svarbūs?
- Kodėl vandenilinis ryšys atsiranda tarp vandens molekulių, bet jo nėra tarp vandenilio molekulių?
- Palyginkite atomų, iš kurių sudarytos toliau pateiktos molekulės, elektrinį neigiamumą bei ryšio tipą (polinis ar nepolinis) ir nurodykite, ar susidarys tarpmolekulinis ryšys:
- tarp HCl molekulių;
- tarp HF molekulių;
- tarp CH4 molekulių.
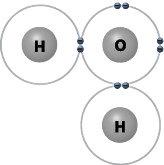
- Pažvelkite į toliau pateiktą vandens molekulės modelį. Šios molekulės deguonies atomas turi dvi laisvas elektronų poras. Viena elektronų pora gali sudaryti vieną vandenilinį ryšį su kitos vandens molekulės vandenilio atomu. Kiek vandenilinių ryšių gali sudaryti viena vandens molekulė?
- Atlikite eksperimentą. Užlašinkite spiritinio jodo tirpalo ant šviesios duonos gabalėlio. Ką pastebėjote? Kodėl pakito jodo spalva?
Ko išmokome?
- Tarpmolekuliniai ryšiai susidaro tarp atskirų molekulių ir yra silpnesni už kovalentinius ar joninius ryšius.
- Tarp didelės molekulės atskirų atomų gali susidaryti silpni ryšiai, kurie yra panašūs į tarpmolekulinius ryšius tarp atskirų molekulių.
- Tarpmolekuliniai ryšiai yra labai svarbūs palaikant sudėtingų ir didelių molekulių sandarą.
- Vienas svarbiausių yra vandenilinis ryšys. Jis susiformuoja tarp kovalentinį polinį ryšį sudariusio ir dalinį teigiamąjį krūvį įgijusio vandenilio atomo ir kitos molekulės neigiamąjį polių turinčio atomo.
- Sluoksninė grafito sandara palaikoma silpnų ryšių tarp anglies atomų.

