Cheminių junginių tipai
Skirtingos medžiagų savybės priklauso nuo to, kokiu cheminiu ryšiu sujungti jas sudarantys junginiai. Skiriami du pagrindiniai cheminių junginių tipai:
- Jòniniai junginiai, kurių atomai sujungti joniniu ryšiu, pavyzdžiui, natrio chloridas (NaCl).
- Kovaleñtiniai junginiai, kurių atomai sujungti kovalentiniu ryšiu, pavyzdžiui, vandenilio chloridas (HCl), vandenilio molekulė (H2) ir kt.
Kovalentiniai junginiai sudaro atskiras molekules.
Ankstesnėse klasėse sužinojome, kad medžiagų savybės apibūdinamos lydymosi ir virimo temperatūra, agregatine būsena esant kambario temperatūrai, tirpumu vandenyje arba kituose tirpikliuose. Dabar išsiaiškinkime joninių ir kovalentinių junginių savybes.
Joninių junginių savybės
Pirmiausia panagrinėkime pagrindines joninių junginių savybes. Kaip jau minėjome, svarbiausia joninių junginių ypatybė ta, kad jie sudaryti iš krūvį turinčių dalelių – jonų. Dėl stiprios priešingų krūvių jonų traukos joniniai junginiai sudaro įvairios formos kristalus – kristalinę gardelę (3.4.1 pav.).
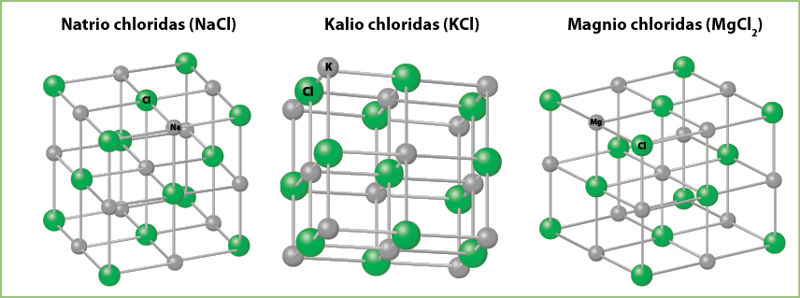
Galima išskirti šias joninių junginių savybes:
- Tai kietosios medžiagos.
- Aukšta lydymosi temperatūra.
- Trapumas.
- Kristalinė sandara (gardelė).
- Dauguma medžiagų yra tirpios vandenyje.
- Kietosios medžiagos nelaidžios elektros srovei, ištirpintos arba išlydytos – laidžios.
- Joninių junginių formulės atspindi jonų santykį gardelėje.
Pavyzdžiui, esant kambario temperatūrai, joniniai junginiai visada yra kietosios medžiagos, kurių lydymosi temperatūra gana aukšta (3.4.1 lentelė).
3.4.1 lentelė. Kai kurių joninių junginių lydymosi temperatūra
Junginio pavadinimas | Formulė | Lydymosi temperatūra, °C |
Ličio chloridas | LiCl | 605 |
Natrio chloridas (valgomoji druska) | NaCl | 801 |
Kalio chloridas | KCl | 770 |
Natrio fluoridas | NaF | 993 |
Kalio jodidas | KI | 981 |
Magnio chloridas | MgCl2 | 614 |
Kalcio chloridas | CaCl2 | 772 |
Kiek kitaip yra su joninių junginių tirpumu. Vanduo yra polinis tirpiklis (žr. 3.3 temą), todėl tirpina jonines medžiagas. Tačiau ne visi joniniai junginiai tirpsta. Pavyzdžiui, natrio chloridas (NaCl) yra tirpus, o sidabro chloridas (AgCl) visiškai netirpsta, nors taip pat yra joninis junginys. Kodėl?
Tirpstant labai svarbus vandens molekulių vaidmuo. Polinės vandens molekulės, įsiterpdamos tarp natrio ir chlorido jonų, atskiria teigiamuosius natrio ir neigiamuosius chlorido jonus (3.4.2 pav.).
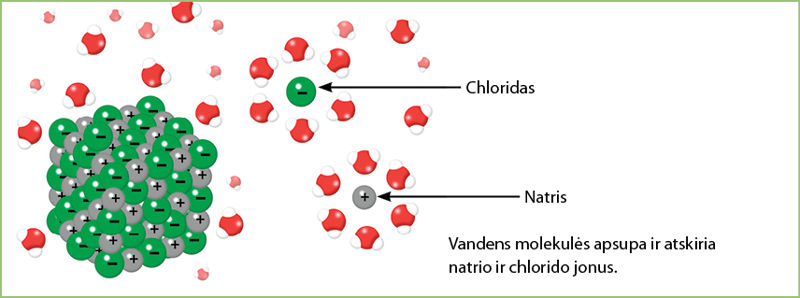
Teigiamuosius natrio jonus vandens molekulė apsupa savo neigiamuoju galu (deguonies atomu). Neigiamuosius chlorido jonus vanduo apsupa teigiamuoju galu – vandenilio atomais. Taip jonai atsiskiria ir gali būti nutolę vienas nuo kito, nes juos saugo vandens molekulių sluoksnis.
Natrio chlorido tirpalui būdinga dar viena savybė. Jis tampa laidus elektros srovei. Atlikime tyrimą.
Tyrimas
Natrio chlorido tirpalo elektrinis laidumas
Darbo tikslas: ištirti natrio chlorido tirpalo elektrinį laidumą.
Jums reikės:
- žiupsnelio valgomosios druskos (natrio chlorido);
- distiliuoto vandens;
- stiklinėlės;
- dviejų elektrodų (grafitinių arba nerūdijančiojo plieno strypelių);
- jungiamųjų laidų;
- nuolatinės srovės šaltinio (pvz., 9 V baterijos);
- lemputės;
- gnybtų.
Darbo eiga:
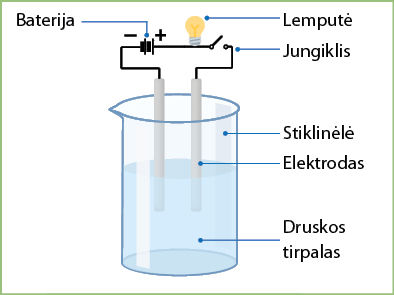
- Surinkite elektros schemą, kaip pavaizduota 3.4.3 paveiksle.
- Į stiklinėlę įpilkite distiliuoto vandens.
- Įmerkite elektrodus į vandenį ir patikrinkite jo elektrinį laidumą (jei lemputė įsižiebia – vanduo laidus elektros srovei, jei neįsižiebia – nelaidus).
- Į vandenį įberkite žiupsnelį druskos ir gerai išmaišykite.
- Patikrinkite gauto tirpalo elektrinį laidumą.
Paaiškinimas. Distiliuotas vanduo, nors ir sudarytas iš polinių vandens molekulių, yra nelaidus elektros srovei. Valgomoji druska vandenyje suskyla į teigiamuosius natrio ir neigiamuosius chlorido jonus. Jonai juda prie priešingo krūvio elektrodų (natrio prie neigiamojo, o chlorido – prie teigiamojo). Taip uždaroma grandinė, ir tirpalas tampa laidus elektros srovei.
Joninių junginių tirpalai ir lydalai laidūs elektros srovei.
Jau minėjome, kad sidabro chloridas (AgCl) yra netirpus. Tai kristalinė baltos spalvos medžiaga. Ji netirpsta ne tik vandenyje, bet ir rūgštiniuose tirpaluose. Tai labai reta chloridų savybė, nes dauguma jų tirpūs. Anksčiau sidabro chloridas buvo naudojamas fotografijai. Sidabro chlorido kristalinė gardelė (3.4.4 pav.) labai panaši į valgomosios druskos (natrio chlorido) kristalinę gardelę. Tad kodėl sidabro chloridas yra netirpus?
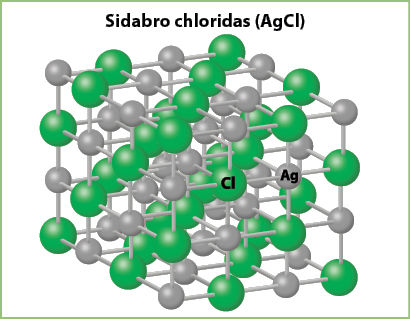
Vandens molekulės negali atskirti sidabro chlorido jonų, nes šie labai stipriai susijungę. Esama ir daugiau netirpių joninių junginių. Apie tokius junginius sužinosite vėliau.
Vandens molekulės negali atskirti jonų iš netirpių joninių junginių kristalų, nes šių medžiagų tarpusavio ryšys yra labai stiprus.
Kovalentinių junginių savybės
Dabar panagrinėkime kovalentinius junginius. Jų pavyzdžiai yra vanduo (H2O), anglies dioksidas (CO2), amoniakas (NH3) (3.4.5 pav.) ir kiti.
Galima išskirti šias kovalentinių junginių savybes:
- Kovalentiniai junginiai gali būti poliniai arba nepoliniai. Tai priklauso nuo juos sudarančių elementų sandaros ir elektrinio neigiamumo skirtumo.
- Kovalentinių junginių lydymosi ir virimo temperatūra labai skirtinga, bet paprastai ji žemesnė nei joninių junginių.
- Kambario temperatūroje kovalentiniai junginiai gali būti dujinės, skystosios arba kietosios būsenos.
- Nepoliniai kovalentiniai junginiai netirpsta vandenyje.
Palyginkime kai kurių kovalentinių junginių savybes (3.4.2 lentelė).
3.4.2 lentelė. Kai kurių kovalentinių junginių savybės
Junginys | Formulė | Poliškumas | Agregatinė būsena, esant 20 °C temperatūrai | Lydymosi temperatūra, °C | Tirpumas vandenyje |
Vandenilis | H2 | Nepolinis | Dujos | –259,2 | Netirpus |
Azotas | N2 | Nepolinis | Dujos | –210 | Netirpus |
Siera | S8 | Nepolinis | Kietoji medžiaga | 112,8 | Netirpus |
Jodas | I2 | Nepolinis | Kietoji medžiaga | 113,7 | Netirpus |
Vandenilio chloridas | HCl | Polinis | Dujos | –114,2 | Tirpus |
Amoniakas | NH3 | Polinis | Dujos | –77,7 | Tirpus |
Metanas | CH4 | Nepolinis | Dujos | –182 | Netirpus |
Anglies dioksidas | CO2 | Polinis | Dujos | –78,5 (sublimacija) | Mažai tirpus |
Kaip matyti iš 3.4.2 lentelėje pateiktų pavyzdžių, tik keli kovalentiniai junginiai yra tirpūs vandenyje. Pavyzdžiui, vandenilio chloridas sudaro polinę molekulę, nes šio junginio elementų elektrinio neigiamumo skirtumas – net 0,94. Tas pats pasakytina ir apie amoniaką: azoto ir vandenilio elektrinio neigiamumo skirtumas 0,84. Užtat metano molekulė yra nepolinė. Anglies ir vandenilio ryšys beveik nepolinis, skirtumas tėra 0,35. Todėl metanas visiškai netirpsta vandenyje ir tuo skiriasi nuo vandenilio chlorido ir amoniako.
Tai įdomu!
Gamtoje metanas susidaro iš pūvančio kūdros arba ežero dumblo. Įbridus į dumblą dažnai galima pastebėti, kaip kyla dujų burbuliukai (3.4.6 pav.). Šios bekvapės metano dujos yra labai degios.

Aptarti joninių ir kovalentinių junginių savybių skirtumai apibendrinti 3.4.3 lentelėje.
3.4.3 lentelė. Svarbesnės joninių ir kovalentinių junginių savybės
Joninių junginių savybės | Kovalentinių junginių savybės |
Kietosios medžiagos | Dujos, skysčiai arba kietosios medžiagos |
Aukšta lydymosi temperatūra | Paprastai – žema lydymosi temperatūra |
Kietosios medžiagos nelaidžios elektros srovei, ištirpintos – laidžios | Dažniausiai nelaidūs elektros srovei |
Dauguma – tirpūs | Poliniai – tirpūs, nepoliniai – netirpūs |
Nesudaro molekulių | Sudaro molekules |
Klausimai ir užduotys
- Kas būdinga joniniams junginiams? Kodėl vieni joniniai junginiai tirpsta vandenyje, o kiti netirpsta?
- Palyginkite joninių ir kovalentinių junginių sandaros ir savybių skirtumus. Ar joniniai junginiai sudaro atskiras molekules? Ar esant kambario temperatūrai būna dujinių joninių junginių?
- Kurios medžiagos dalelės sujungtos joniniu ryšiu?
- HF
- O2
- NaF
- NH3
- Į kokius jonus suskils vandenyje ištirpintas kalio chloridas (KCl)? Remdamiesi 3.4.2 paveikslu, pavaizduokite atskirtus kalio ir chlorido jonus vandenyje.
- Persibraižykite lentelę ir joje įrašykite nurodytų junginių savybes.
Pavadinimas | Formulė | Elementų elektrinio neigiamumo skirtumas | Joninis ar kovalentinis junginys | Sandara: kristalinė ar molekulinė | Ryšio poliškumas | Tirpumas vandenyje |
Ličio chloridas | LiCl | |||||
Vandenilio fluoridas | HF | |||||
Fosforas | P4 | |||||
Kalio bromidas | KBr | |||||
Silicio hidridas | SiH4 |
Ko išmokome?
- Joniniai junginiai yra kietosios medžiagos, kurioms būdinga aukšta lydymosi temperatūra.
- Joniniai junginiai paprastai būna kristalinės sandaros.
- Kietosios būsenos joniniai junginiai nelaidūs elektros srovei, joninių junginių tirpalai – laidūs.
- Tirpstant joniniams junginiams, vandens molekulės atskiria jonus ir apsupa juos.
- Vandens molekulės negali atskirti jonų iš netirpių joninių junginių kristalų, nes šių medžiagų jonų tarpusavio ryšys yra labai stiprus.
- Kovalentiniai junginiai sudaryti iš atskirų molekulių, joniniai – iš jonų.
- Kovalentiniai junginiai – tai dujos, skysčiai arba kietosios medžiagos.
- Dauguma kovalentinių junginių netirpūs, ypač kovalentiniai nepoliniai junginiai.

