Kovalentinių junginių formulių sudarymas
Tarpusavyje susijungę nemetalai sudaro junginius, kurie vadinami kovalentiniais junginiais. Skirtingai nuo joninių junginių, kovalentiniai junginiai sudaro molekules. Kovalentinių junginių molekulėse elementų atomų krūvis nėra išreikštas taip kaip jonų joniniuose junginiuose.
Kaip sudaromos kovalentinių junginių cheminės formulės?
Nors susidarant kovalentiniams junginiams jonų negaunama, šių junginių formulių sudarymas yra panašus į joninių junginių formulių sudarymą.
Kovalentinių junginių pavyzdžiai – vanduo (H2O), anglies dioksidas (CO2).
Sudarydami kovalentinių junginių formules darome prielaidą, kad didesnio elektrinio neigiamumo elemento atomas pritraukia tiek elektronų, kiek jų gali atiduoti mažesnio elektrinio neigiamumo elementas. Laikome, kad, kaip ir joniniuose junginiuose, abiejų elementų atomų išorinis elektronų sluoksnis galėtų būti užpildytas.
Sąlygiškai prijungiamų ir atiduodamų elektronų skaičius turi sutapti.
Panagrinėkime vandens ir anglies dioksido molekules (3.6.1 pav.). Deguonies elektrinis neigiamumas yra lygus 3,44, vandenilio – 2,20, o anglies – 2,56. Matome, kad deguonies elektrinis neigiamumas yra didesnis. Tam, kad susidarytų užpildytas deguonies atomo išorinis elektronų sluoksnis, reikia dar 2 elektronų.
Vienas vandenilio atomas gali atiduoti tik vieną elektroną. Taigi, susidarant vandens molekulei, vienam deguonies atomui reikės dviejų vandenilio atomų, vadinasi, vandens formulę užrašysime kaip H2O (3.6.1 pav., a).
Anglis gali atiduoti visus 4 elektronus. Vienam deguonies atomui reikia 2 elektronų. Vadinasi, su vienu anglies atomu jungsis du deguonies atomai, todėl gausime formulę CO2 (3.6.1 pav., b).
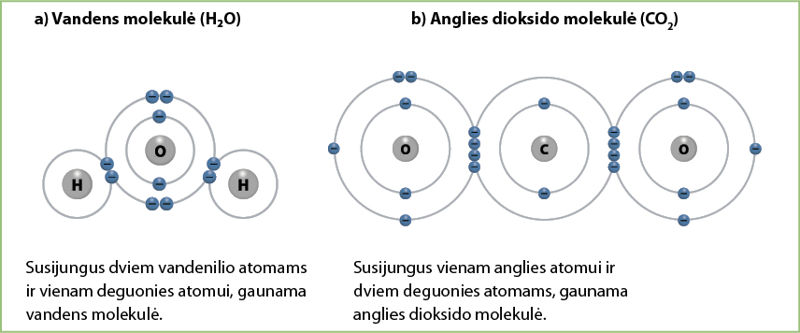
Formulės, kurios rodo elemento atomų skaičių molekulėje, vadinamos molekulinėmis fòrmulėmis.
Mūsų nagrinėtų vandens ir anglies dioksido molekulinės formulės atspindi šių molekulių realią sudėtį.
Net jei elementų elektrinio neigiamumo skirtumas nedidelis, sudarydami kovalentinių junginių formules, vis tiek galime daryti prielaidą apie atomų atiduodamus ir prijungiamus elektronus.
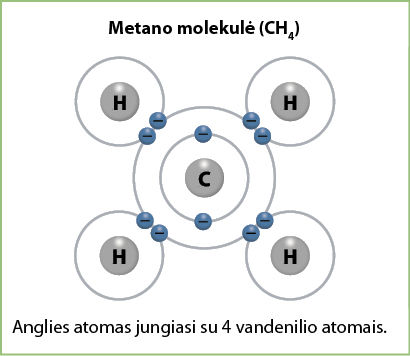
Pavyzdžiui, kokia yra anglies ir vandenilio junginio formulė? Anglies elektrinis neigiamumas yra 2,56, o vandenilio – 2,20, jų skirtumas visai nedidelis, bet anglies elektrinis neigiamumas yra kiek didesnis nei vandenilio. Vadinasi, ir šiuo atveju darome prielaidą, kad anglies atomas pritrauks elektronus, o vandenilio atiduos. Iki užpildyto išorinio elektronų sluoksnio angliai trūksta 4 elektronų. Vandenilio atomas gali atiduoti 1 elektroną. Tam, kad susidarytų molekulė, reikia 4 vandenilio atomų (3.6.2 pav.). Ši medžiaga vadinama metanu, jo formulė CH4. Tai – gamtinės dujos.
Empirinės ir molekulinės kovalentinių junginių formulės
Kovalentinių junginių formulės gali būti empirinės ir molekulinės. Empirinėmis formulėmis rodomas elementų santykis, o molekulinėmis – molekulės sudėtis.
Kovalentinių junginių empirines formules galime parašyti tada, kai molekulinių formulių elementų indeksus galime padalyti iš mažiausio bendrojo kartotinio skaičiaus.
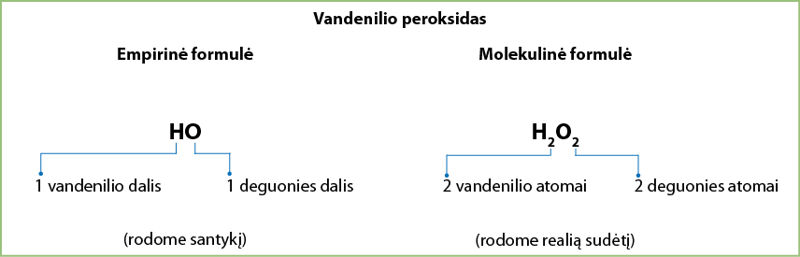
Pavyzdžiui, deguoniui gauti naudojamo vandenilio peroksido molekulinė formulė yra H₂O₂. Šios formulės indeksus galima padalyti iš dviejų.
Vandenilio peroksido junginio empirinę formulę užrašysime kaip HO, o molekulinę formulę kaip H2O2 (3.6.3 pav.)
Valentingumas
Elementų gebėjimas prijungti tam tikrą kito elemento atomų skaičių sudarant molekules vadinamas valentingumu.
Valentingùmas priklauso nuo elemento atomo išorinio elektronų sluoksnio elektronų skaičiaus.
Apibendrindami antrojo periodo elementus, galime palyginti šio periodo elementų valentingumą. Jis pateiktas 3.6.1 lentelėje. Valentingumas nurodomas romėniškais skaitmenimis.
3.6.1 lentelė. Antrojo periodo elementų valentingumas
Elementas | Litis, | Berilis, | Boras, | Anglis, | Azotas, | Deguonis, | Fluoras, | Neonas, |
Valentingumas | I | II | III | IV | III | II | I | O |
Jei elementas gali sudaryti kelis junginius su kitu elementu, užrašant šio junginio pavadinimą, skliausteliuose nurodomas elemento valentingumas.
Pavyzdžiui, siera gali sudaryti net kelis oksidus: SO2 ir SO3. Šių junginių pavadinimai užrašomi taip: pirmasis vadinamas sieros(IV) oksidu, arba sieros dioksidu, antrasis – sieros(VI) oksidu, arba sieros trioksidu.
Tos pačios grupės elementų valentingumas dažniausiai yra panašus. Pavyzdžiui, mūsų nagrinėtos IA grupės metalų valentingumas yra I, kaip ir ličio, nes šie elementai išoriniame sluoksnyje turi po 1 elektroną. VIIA grupės elementų valentingumas taip pat yra I, kaip ir toje grupėje esančio fluoro, nes šiems elementams iki išorinio sluoksnio užpildymo trūksta 1 elektrono. Vadinasi, šių grupių elementai geba prijungti po vieną atomą.
Iš 3.6.1 lentelės matyti, kad vieni antrojo periodo elementai (fluoras, deguonis, azotas, anglis) pritraukia tiek elektronų, kad jų išoriniame elektronų sluoksnyje būtų 8, kiti elementai (litis, berilis, boras, anglis) jų atiduoda tiek, kad turėtų užpildytą žemesnį elektronų sluoksnį. Primename, kad pirmasis užpildytas elektronų sluoksnis turi tik du elektronus, o antrasis ir trečiasis – po 8. Taigi, norint apskaičiuoti trečiojo periodo elementų valentingumą, reikia suskaičiuoti, kiek elektronų trūksta iki 8 arba kiek jų reikia atiduoti, kad žemesniame elektronų sluoksnyje būtų 8 elektronai.
Elemento valentingumą lengva nustatyti pagal jo junginio su deguonimi formulę. Deguonies valentingumas yra II, vadinasi, pagal tai galima apskaičiuoti kito elemento valentingumą.
Pavyzdžiui, nustatykime natrio valentingumą natrio oksido (Na2O) junginyje.
Jono, gaunamo iš deguonies (oksido), krūvis yra 2– (tiek elektronų pritraukia deguonis). Atitinkamai dviejų natrio jonų krūvis bus 2+ (du natrio atomai atiduoda tiek elektronų ir virsta jonais). Šį krūvį dalijame iš jonų skaičiaus ir gauname natrio valentingumą: 2+ / 2 = I.
Dabar nustatykime aliuminio valentingumą aliuminio oksido (Al2O3) junginyje.
Deguonies krūvis yra 2–. Dauginame šį krūvį iš 3 jonų, gauname bendrą deguonies krūvį, lygų 6–. Vadinasi, dviejų aliuminio jonų krūvis bus priešingas – 6+. Apskaičiuojame aliuminio valentingumą: 6+ / 2 = III.
Klausimai ir užduotys
- Kaip sudaromos kovalentinių junginių formulės?
- Kas yra valentingumas? Koks elemento natrio valentingumas?
- Sudarykite azoto(V) oksido formulę.
- Nustatykite sieros valentingumą junginyje SF6.
- Nustatykite šių junginių empirines formules:
- C2H2;
- C4H10;
- C6H6.
Ko išmokome?
- Kovalentinių junginių formulės gali būti empirinės ir molekulinės.
- Kovalentinių junginių empirinės formulės rodo elementų santykį, o molekulinės – molekulės sudėtį.
- Sudarydami kovalentinių junginių formules darome prielaidą, kad didesnio elektrinio neigiamumo elemento atomas prijungia tiek elektronų, kiek jų gali atiduoti mažesnio elektrinio neigiamumo elementas. Taip galėtų susidaryti užpildyti abiejų elementų atomų išoriniai elektronų sluoksniai.
- Sąlygiškai prijungiamų ir atiduodamų elektronų skaičius turi sutapti.
- Perioduose atomo spindulys mažėja iš kairės į dešinę.
- Elementų gebėjimas prijungti tam tikrą kito elemento atomų skaičių sudarant molekules vadinamas valentingumu.

