Cheminių reakcijų tipų skirtumai
Cheminės reakcijos skirstomos į keturis pagrindinius tipus:
- Jungimosi: tarpusavyje susijungia dvi ar daugiau medžiagų.
- Skilimo: medžiaga suskyla į dvi ar daugiau medžiagų.
- Pavadãvimo: vieninės medžiagos atomai pakeičia vieno iš sudėtinės medžiagos elementų atomus.
- Mainų: medžiagos apsikeičia jonais. Mainų reakcijos vyksta tirpaluose.
Atlikime tyrimus ir atidžiau panagrinėkime šias reakcijas.
Skilimo reakcijos
Skilimo reãkcija – tai tokia reakcija, kuriai vykstant susidaro kelios naujos medžiagos.
Tyrimas
Vandenilio peroksido skilimas veikiant mielėms
Darbo tikslas: stebėti vandenilio peroksido skilimą veikiant mielėms.
Jums reikės:
- 5 ml vandenilio peroksido tirpalo;
- gabalėlio šviežių arba žiupsnelio sausų kepimo mielių;
- medinės skalelės;
- degtukų;
- mėgintuvėlio arba stiklinėlės.
Darbo eiga:
- Į aukštą mėgintuvėlį arba stiklinėlę įdėkite gabalėlį mielių arba įberkite sausų mielių.
- Ten pat įpilkite vandenilio peroksido.
- Uždekite medinę skalelę ir tuoj pat užpūskite, kad rusentų jos galiukas.
- Įkiškite skalelę į mėgintuvėlį virš putojačio skysčio (4.2.1 pav.).
- Stebėkite skalelės kitimus.
Paaiškinimas. Veikiamas mielių vandenilio peroksidas suskyla į du junginius: vandenį ir deguonį. Dėl išsiskyrusio deguonies užsiliepsnoja rusenanti skalelė – tai deguonies gautame tirpale atpažinimo reakcija. Įvykusią skilimo reakciją galima užrašyti tokia lygtimi:
2H2O2(aq) → | 2H2O(s) + | O2(d). |
Vandenilio peroksido tirpalas | Vanduo | Deguonis |
(4.2.1)
Iš peroksido tirpalo išsiskyrus deguoniui, skalelė užsiliepsnoja.
Kaip šioje reakcijoje veikia mielės? Mielės yra šios reakcijos katalizatorius. Jos labai pagreitina vykstančią reakciją, bet pačios neįeina į reakcijos produktų sudėtį, t. y. nėra sueikvojamos.
Katalizãtoriais vadinamos medžiagos, kurios pagreitina chemines reakcijas, bet pačios nėra sueikvojamos.
Jungimosi reakcijos
Jungimosi reãkcija – tokia reakcija, kuriai vykstant iš dviejų ar daugiau reaguojančiųjų medžiagų susidaro viena nauja medžiaga.
Šios reakcijos pavyzdys – degimas. Pirmiau tyrinėjome, kaip metalai magnis ir aliuminis dega ore. Tai metalų jungimosi su deguonimi reakcija. Dabar patyrinėkime, kaip dega siera.
Tyrimas
Sieros jungimasis su oro deguonimi
Darbo tikslas: stebėti sieros degimo reakciją.
Jums reikės:
- metalinio šaukštelio;
- gabalėlio sieros;
- degiklio;
- degtukų (jei reikia).
Pastaba. Šis darbas atliekamas traukos spintoje!
Darbo eiga:
- Į metalinį šaukštelį įberkite nedaug sieros.
- Uždekite degiklį.
- Įkiškite šaukštelį su siera į degiklio liepsną.
- Stebėkite silpną sieros degimą ir baltų troškių dūmų susidarymą.
Paaiškinimas. Vykstant šiai reakcijai siera jungiasi su deguonimi, susidaro sieros dioksidas. Daug stipresnė reakcija vyksta, kai siera dega gryname deguonyje (4.2.2 pav.). Šios reakcijos lygtis:
S(k) + | O2(d) → | SO2(d). |
Siera | Deguonis | Sieros dioksidas |
(4.2.2)

Pavadavimo reakcijos
Nagrinėdami VIIA grupės elementus išsiaiškinome, kad visų šios grupės elementų elektrinis neigiamumas didelis, ypač fluoro (žr. 3.1 temą). Vadinasi, jie gebės prisijungti elektronus iš tos pačios grupės elementų jonų (4.2.1 lentelė).
4.2.1 lentelė. VIIA grupės elementų aktyvumo palyginimas
VIIA grupės elementas, formulė | Iš kokio VIIA grupės elemento neigiamojo jono prisijungs elektronus |
Fluoras (F2) | Iš chlorido (Cl–), bromido (Br–), jodido (I–) |
Chloras (Cl2) | Iš bromido (Br–), jodido (I–) |
Bromas (Br2) | Iš jodido (I–) |
Jodas (I2) | - |
Mokytojo padedami atlikite tyrimą ir stebėkite VIIA grupės elementų sąveikos skirtumus.
Pavadãvimo reãkcija – reakcija tarp vieninės ir sudėtinės medžiagos, kuriai vykstant susidaro nauja vieninė ir nauja sudėtinė medžiaga.
Tyrimas
Chloro reakcija su kalio jodidu
Darbo tikslas: stebėti jodo išstūmimo iš kalio jodido tirpalo reakciją.
Jums reikės:
- baliklio, kurio sudėtyje yra chloro (veiklioji medžiaga – natrio hipochloritas);
- citrinų rūgšties;
- kalio jodido;
- filtruojamojo popieriaus;
- mėgintuvėlio laikiklio;
- mėgintuvėlio;
- pinceto;
- žirklių.
Darbo eiga:
- Mėgintuvėlyje ištirpinkite žiupsnelį kalio jodido.
- Atkirpkite juostelę filtruojamojo popieriaus ir, sutvėrę pincetu, įmerkite ją į kalio jodido tirpalą. Ištraukite juostelę iš tirpalo.
- Į mėgintuvėlį įpilkite nedaug baliklio ir įberkite žiupsnelį citrinų rūgšties.
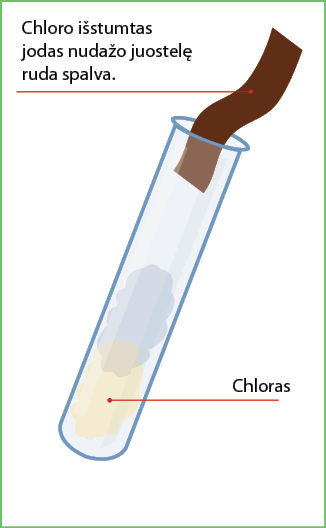
- Dar kartą įmerkite juostelę į gautą tirpalą ir greitai ištraukite (4.2.3 pav.).
- Stebėkite juostelės spalvos pokytį.
Pastaba. Jokiu būdu neuostykite išsiskiriančių dujų, jos nuodingos!
Paaiškinimas. Esant rūgšties, iš baliklio išsiskiria chloras. Jam būdingas aitrus kvapas. Chloras reaguoja su kalio jodidu ir išstumia iš jo jodą. Todėl filtruojamasis popierius paruduoja. Šios reakcijos lygtis:
Cl2(d) + | 2KI(aq) → | 2KCl(aq) + | I2(k). |
Chloras | Kalio jodidas | Kalio chloridas | Jodas |
(4.2.3)
Chloras pakeičia jodido joną, susidaro chlorido jonas ir jodas.
Mainų reakcijos
Mainų reãkcija – tokia reakcija, kuriai vykstant medžiagos apsikeičia savo jonais ir susidaro dvi naujos medžiagos.
Tam, kad medžiagos apsikeistų jonais, turi būtinai susidaryti nuosėdos, dujos arba vanduo.
Panagrinėkime natrio ir sieros junginio natrio sulfido reakciją su vandenilio chlorido tirpalu. Vykstant reakcijai susidaro dujinė medžiaga, dvokianti supuvusiais kiaušiniais, – vandenilio sulfidas. Dėl nemalonaus kvapo šis eksperimentas mokykloje neatliekamas.
Sumaišius natrio sulfido ir vandenilio chlorido tirpalus išsiskiria dujos. Sulfido ir chlorido jonai apsimaino vienas su kitu. Šios reakcijos lygtis:
Na2S(aq) + | 2HCl(aq) → | H2S(d) + | 2NaCl(aq). |
Natrio | Vandenilio | Vandenilio | Natrio |
(4.2.4)
Kaip matote, sulfido jonas apsikeičia su chlorido jonu. Svarbu paminėti, kad mainų reakcijoje dalyvaujančių elementų jonų krūvis nesikeičia.
Klausimai ir užduotys
- Išvardykite pagrindinius cheminių reakcijų tipus.
- Persibraižykite lentelę ir joje įrašykite pateiktų reakcijų tipus.
Reakcija | Reakcijos tipas |
AB → A + B | |
AB + C → AC + B | |
A + B → AB | |
AB + CD → AC + BD | |
- Kokiam reakcijų tipui priskirtumėte šią reakciją:
Zn(k) + CuCl2(aq) → ZnCl2(aq) + Cu(k)?
Išlyginkite šią reakcijos lygtį. - Parašykite du jungimosi reakcijos pavyzdžius.
- Kuri šių reakcijų gali vykti iš tikrųjų? Išlyginkite galinčios vykti reakcijos lygtį.
- NaCl(aq) + Br2(s) → NaBr(aq) + Cl2(d).
- CaBr2(aq) + I2(k) → CaI2(aq) + Br2(s).
- AlI3(aq) + Cl2(d) → AlCl3(aq) + I2(k).
Ko išmokome?
- Yra keturi cheminių reakcijų tipai:
- jungimosi;
- skilimo;
- pavadavimo;
- mainų.
- Vykstant jungimosi reakcijai, tarpusavyje susijungia dvi ar daugiau medžiagų.
- Vykstant skilimo reakcijai, medžiaga suskyla į dvi ar daugiau medžiagų.
- Vykstant pavadavimo reakcijai, vieninės medžiagos atomai pakeičia vieno iš sudėtinės medžiagos elementų atomus. Susidaro nauja vieninė ir nauja sudėtinė medžiaga.
- Vykstant mainų reakcijai, medžiagos apsikeičia jonais ir susidaro dvi naujos medžiagos.

