Endoterminės ir egzoterminės reakcijos
Vykstant cheminėms reakcijoms iš vienų medžiagų gaunamos kitos. Tam, kad tai įvyktų, turi nutrūkti vieni ir susidaryti kiti cheminiai ryšiai. Sąveikaujant įvairioms medžiagoms energija gali būti sunaudojama arba išskiriama.
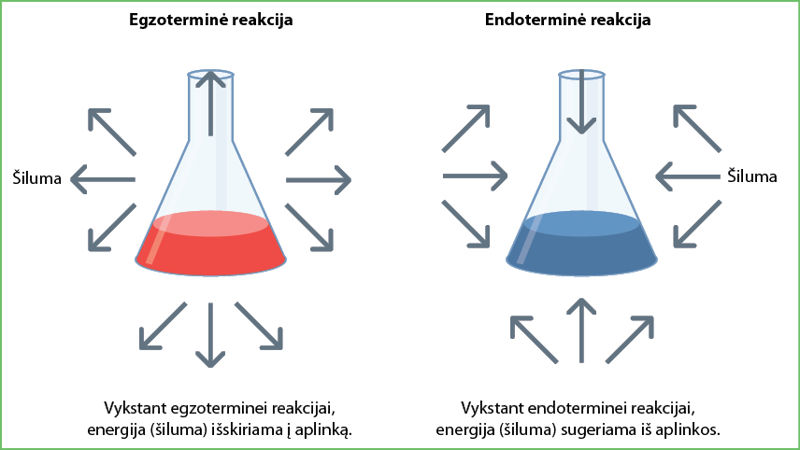
Cheminės reakcijos, kurioms vykstant energija išskiriama, vadinamos egzotèrminėmis reãkcijomis.
Cheminės reakcijos, kurioms vykstant energija sunaudojama, vadinamos endotèrminėmis reãkcijomis.
Šie žodžiai kilę iš graikų kalbos: endo reiškia „viduje“, egzo – „išorėje“, thermē – „šiluma“ (4.5.1 pav.).
3.4.2 paveiksle pavaizduota, kaip tirpsta natrio chloridas – valgomoji druska. Atlikime tyrimą ir patikrinkime, kaip kinta ledo ir valgomosios druskos mišinio temperatūra.
Tyrimas
Ledo ir natrio chlorido mišinio temperatūros pokytis
Darbo tikslas: stebėti, kaip kinta ledo ir valgomosios druskos (natrio chlorido) mišinio temperatūra.
Jums reikės:
- 6–8 ledo kubelių;
- 2 arbatinių šaukštelių smulkios valgomosios druskos;
- grūstuvės ir grūstuvėlio;
- stiklinėlės;
- termometro;
- lazdelės maišyti.
Darbo eiga:
- Grūstuvėje sugrūskite 6–8 ledo kubelius, kad išeitų smulkesni ledo gabaliukai.
- Suberkite grūstą ledą į stiklinėlę.
- Ten pat įberkite du arbatinius šaukštelius smulkios valgomosios druskos ir gerai išmaišykite.
- Įbeskite termometrą į smulkinto ledo ir druskos mišinį.
- Stebėkite mišinio temperatūros pokytį.
Pastaba. Galima keisti druskos kiekį ir tada lyginti temperatūros pokytį.
Paaiškinimas. Druskos ir ledo mišinys labai atšąla. Reikiama energija imama iš aplinkos, todėl ši reakcija – endoterminė.

Druskos kristalui suardyti vandens molekulės turi nutraukti joninius ryšius tarp natrio ir chlorido jonų. Tam reikalinga energija imama iš aplinkos. Šiems pradiniams ryšiams suardyti energijos sunaudojama daugiau, nei jos išsiskiria susidarant naujiems ryšiams tarp natrio ir chlorido jonų, apsuptų vandens molekulių, todėl druskos ir ledo mišinys atšąla, druska ima tirpinti ledą. Ši druskos savybė naudojama žiemą. Išbarsčius druskos ant apledėjusio kelio, ledas ima tirpti, mišinys suskystėja ir neleidžia susidaryti ledo sluoksniui (4.5.3 pav.).

Atlikime kitą tyrimą ir išsiaiškinkime, kokia vyks reakcija – endoterminė ar egzoterminė.
Tyrimas
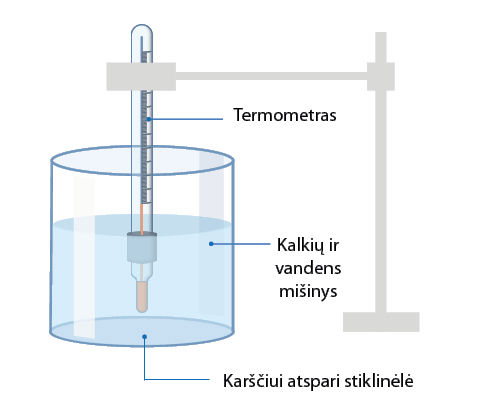
Kalcio oksido ir vandens mišinio temperatūros pokytis
Darbo tikslas: stebėti, kaip kinta kalcio oksido ir vandens mišinio temperatūra.
Jums reikės:
- 1 dalies kalcio oksido (negesintų kalkių);
- 3 dalių vandens;
- atsparios karščiui stiklinėlės;
- termometro;
- laboratorinio stovo su laikikliu;
- lazdelės maišyti.
Darbo eiga:
- Į sausą stiklinėlę įberkite sauso kalcio oksido (negesintų kalkių).
- Įtvirtinkite termometrą, naudodami stovą su laikikliu.
- Pastatykite stiklinėlę ir įbeskite termometro galiuką į kalkes (4.5.4 pav.).
- Ant kalkių atsargiai užpilkite vandens (nepamirškite apsauginių akinių!).
- Stebėkite, kaip kinta mišinio temperatūra.
Paaiškinimas. Vykstant šiai reakcijai kalcio oksidas reaguoja su vandeniu, susidaro naujas junginys – kalcio hidroksidas (gesintos kalkės). Į aplinką skleidžiama šiluma, todėl kalcio oksido sąveika su vandeniu yra egzoterminė reakcija.
Reakcijos lygtis:
CaO(k) + | H2O(s) → | Ca(OH)2(aq) + | išskiriama šiluma. |
Kalcio oksidas | Vanduo | Kalcio hidroksidas | |
(4.5.1)
Apie kalcio hidroksido sandarą ir savybes kalbėsime vyresnėse klasėse. Šis junginys yra labai svarbus statybos pramonėje. Negesintos kalkės (kalcio oksidas) naudojamos statiniams mūryti, tinkuoti, medeliams balinti (4.5.5 pav.). Kalcio oksido yra ir cemento sudėtyje. Cementas gaunamas iškasamas klintis veikiant ypač aukšta temperatūra.

Tai įdomu!
Didžiulės klinčių, tinkamų cemento gamybai, atsargos glūdi Šiáurės Lietuvojè (4.5.6 pav.), todėl šalia Naujósios Akmẽnės pastatyta cemento gamykla. Cementas gaminamas išdegus klintis, sumaišytas su moliu ir kitais priedais. Kasmet šioje gamykloje pagaminama daugiau kaip 1 milijonas tonų cemento. Klinčių skaidymas yra endoterminė reakcija.

Keletas endoterminių ir egzoterminių reakcijų pavyzdžių pateikta 4.5.1 lentelėje.
4.5.1 lentelė. Endoterminės ir egzoterminės reakcijos
Reakcijos tipas | Šilumos pokytis | Pavyzdžiai |
Egzoterminė | Šiluma išskiriama | Degimo reakcijos, puvimas, rūdijimas |
Endoterminė | Šiluma sunaudojama | Druskos tirpinimas, kreidos, klinčių skaidymas, fotosintezė |
Aktyvacijos energija
Jokia cheminė reakcija negali vykti be energijos. Prisiminkime druskos sąveiką su ledu. Jau minėjome, kad natrio ir chlorido jonų ryšiui suardyti reikia energijos. Net anglis, kuri degdama ore išskiria šilumą, neužsidega savaime. Tam reikia postūmio.
Energija, kurios reikia tam, kad prasidėtų cheminė reakcija, vadinama aktyvãcijos enèrgija.
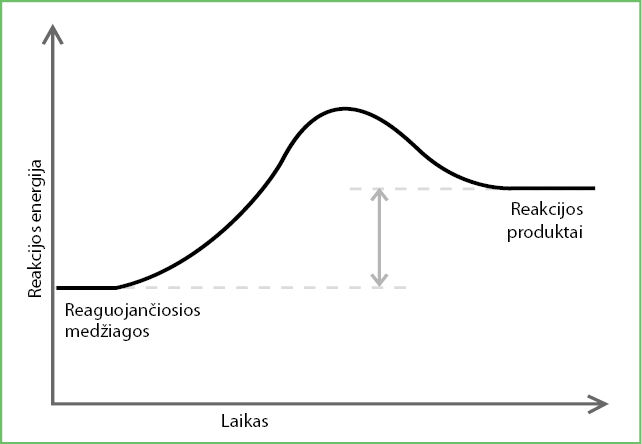
Energijos pokytį vykstant cheminėms reakcijoms galima pavaizduoti reakcijos energijos kreive (4.5.7 pav.).
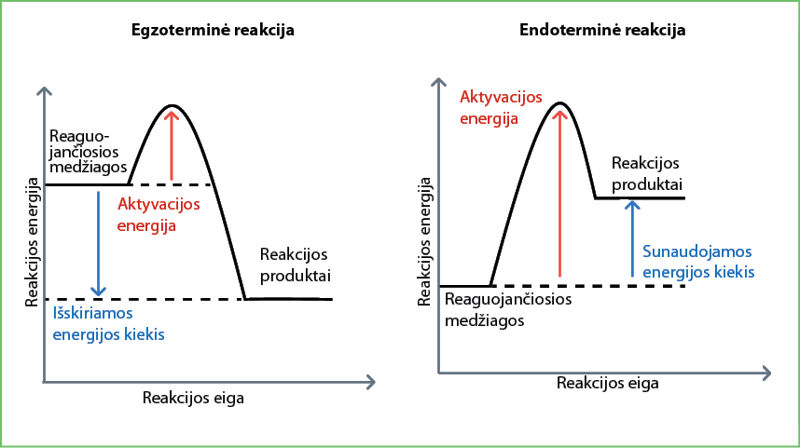
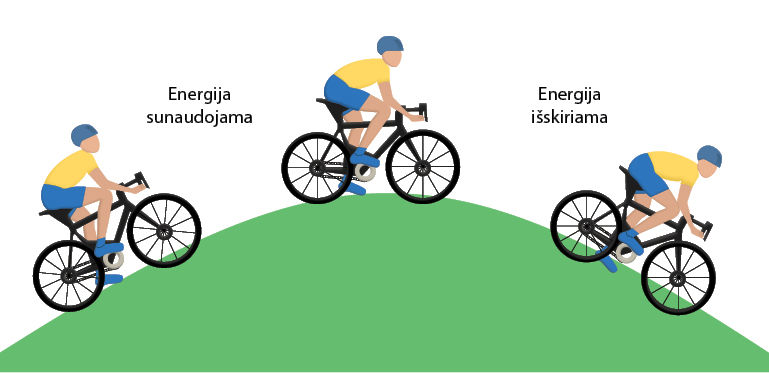
Prasidėjus reakcijai sunaudota aktyvacijos energija niekur nedingsta – ji vėl išskiriama. Tai tarsi važiavimas dviračiu. Jei kelyje pasitaiko kalniukas, reikia papildomų pastangų, kad į jį užvažiuotum. Sunaudota energija sugrįžta, kai dviratis laisvai rieda nuo kalniuko ir pedalų minti nebereikia (4.5.8 pav.).
Jei pradinių medžiagų energija yra didesnė nei susidariusių produktų, papildomai išsiskiria tam tikras energijos kiekis. Tai būdinga egzoterminėms reakcijoms. Energijos išskyrimą į aplinką stebėjome sumaišę kalcio oksidą su vandeniu, kai mišinys stipriai įkaito. Egzoterminėms reakcijoms nebereikia papildomos energijos, jos toliau vyksta pačios.
Jei pradinių medžiagų energija mažesnė nei susidariusių produktų, tam, kad vyktų reakcija, reikia papildomos energijos. Tai būdinga endoterminėms reakcijoms. Endoterminė reakcija vyksta tik tol, kol jai suteikiama papildomos energijos. Endoterminė reakcija vyktų, jei pakaitintume pirmiau aprašytos kalcio oksido ir vandens reakcijos produktą – kalcio hidroksidą. Vėl gautume negesintas kalkes:
Ca(OH)2(k) → | CaO(k) + | H2O(s) – | sugeriama |
Kalcio hidroksidas | Kalcio oksidas | Vanduo | |
(4.5.2)
Taigi negesintų kalkių gavimas deginant gesintas kalkes yra endoterminė reakcija. Kol vyksta ši reakcija, visą laiką turi būti palaikoma itin aukšta temperatūra.
Klausimai ir užduotys
- Kas yra endoterminės ir egzoterminės reakcijos? Kaip jos pasireiškia? Kam reikalinga reakcijos aktyvacijos energija?
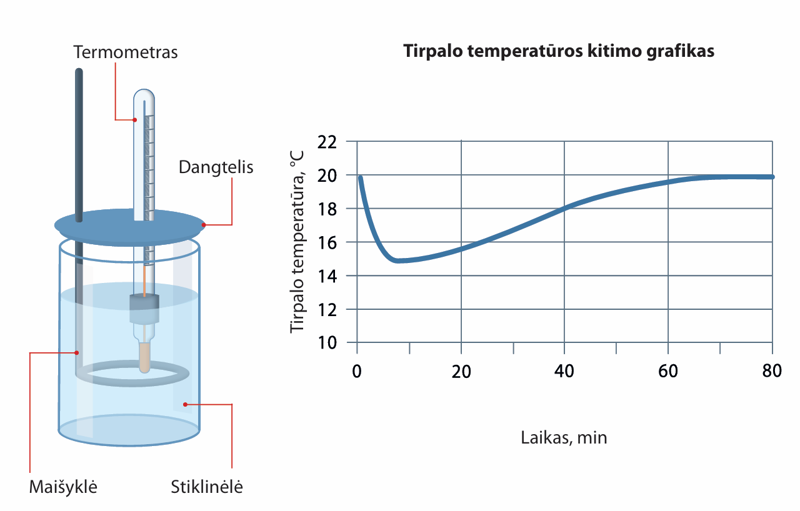
- Stiklinėlėje nuolat maišant tirpalą buvo tirpinama medžiaga. Tirpalo temperatūra matuota kas 10 minučių. Gautas tirpalo temperatūros kitimo grafikas pavaizduotas paveiksle. Paaiškinkite, kokia reakcija įvyko – endoterminė ar egzoterminė.
- Toliau pateiktame paveiksle pavaizduota endoterminės reakcijos energijos kreivė. Persibraižykite šią schemą ir joje rodyklėmis nurodykite, kokio dydžio aktyvacijos energija reikalinga reakcijai pradėti, kiek energijos sunaudojama (arba kiek jos išskiriama) vykstant šiai cheminei reakcijai.
- Sieros rūgšties tirpinimas vandenyje yra egzoterminė reakcija. Koncentruotos sieros rūgšties tankis beveik dvigubai didesnis už vandens tankį. Paaiškinkite, kodėl sieros rūgštį reikia pilti į vandenį, o ne atvirkščiai. Kodėl atliekant šį eksperimentą būtini apsauginiai akiniai?
- Gamtinės dujos, sumaišytos su oru tam tikru santykiu, gali sprogti. Sprogimas įvyksta tik įžiebus kibirkštį arba uždegus degtuką. Paaiškinkite, kodėl. Kokia tai reakcija: egzoterminė ar endoterminė?
Ko išmokome?
- Cheminės reakcijos, kurioms vykstant energija išskiriama, vadinamos egzoterminėmis reakcijomis.
- Cheminės reakcijos, kurioms vykstant energija sunaudojama, vadinamos endoterminėmis reakcijomis.
- Energija, kurios reikia cheminei reakcijai pradėti, vadinama aktyvacijos energija.
- Jei susidariusių produktų energija yra mažesnė nei pradinių medžiagų, papildomai išskiriamas tam tikras energijos kiekis.
- Jei produktų energija yra didesnė už pradinių medžiagų energiją, tam, kad vyktų reakcija, būtina papildoma energija.

