Kaip susidaro ugnis
Ugnis nuo seno žmonėms – labai svarbi. Buvo sunku ją uždegti, nes degtukai sukurti tik XIX a., todėl ugnis labai saugota ir garbinta. Pavyzdžiui, pagal pagonių tikėjimą, ugnis buvo šventa. Ji naudota maistui ruošti, gyvenamajam būstui šildyti. Ugnis žmonėms ne tik suteikė šilumos – tamsiuoju metu ji buvo šviesos šaltinis iki pat XIX a., kol išrasta elektra. Iki tol naudotos balanos, žvakės, įvairūs deglai. Laužai kurti ne tik kaip aukuras, bet ir kaip signalas artinantis priešui.
Degti gali tiek organinės (įvairios gyvūninės ar augalinės medžiagos, tokios kaip mediena, riebalai, vaškas), tiek neorganinės (iš žemės iškastos arba iš mineralų pagamintos, tokios kaip siera, anglis, dauguma metalų) medžiagos. Namams apšviesti naudotos žvakės, pagamintos sulydžius bičių vašką (2.4.1 pav.).

Degimas yra cheminis medžiagų kitimas: medžiagos jungiasi su deguonimi, išsiskiria šiluma ir šviesa, susidaro naujų junginių.
Dega ne visos medžiagos, pavyzdžiui, vanduo, anglies dioksidas ir smėlis nedega. Šios medžiagos yra elementų – vandenilio, anglies, silicio – junginiai su deguonimi. Vanduo, anglies dioksidas ir smėlis naudojami ugniai gesinti. Nedidelį ugnies šaltinį galima gesinti ir tankiu audeklu – jei nepatenka deguonies, ugnis užgęsta (2.4.2 pav.).

Kaip degimas gali vykti be deguonies? Tai neįmanoma. Deguonis yra būtinas. Jei nėra aplinkoje, jo turi būti pasigaminama.
Tai įdomu!
Raketų varikliams būtinas deguonis pagaminamas iš raketiniame kure esančių medžiagų. Kosminėse raketose naudojamas suskystintasis deguonis. Todėl raketa, skirtingai nei reaktyvinis lėktuvas, gali nuskristi net ten, kur nėra deguonies, pavyzdžiui, į Mėnulį. Tas pats vyksta leidžiant fejerverkus – jų mišinių sudėtyje yra deguonies. Net sukurti po vandeniu galintys degti deglai!
Deguonies savybės
Grynas deguonis labai suaktyvina degimą. Tai galima pastebėti į rusenančias žarijas pučiant orą. Kalviai į žaizdrą orą pūsdavo odinėmis dumplėmis. Dėl papildomo deguonies pakyla degimo temperatūra, taigi metalas (geležis) daug lengviau lydosi (2.4.3 pav.). Dar geriau medžiagos dega gryname deguonyje.

Eksperimentinis darbas „Deguonies pasigaminimas ir jo atpažinimas“
Darbo tikslas: iš kalio permanganato pagaminti deguonį ir jį atpažinti rusenančiu mediniu pagaliuku (2.4.4 pav.).
Hipotezė: kai kurios medžiagos kaitinamos išskiria deguonį, kuris atpažįstamas rusenančiu mediniu pagaliuku.
Jums reikės: mėgintuvėlio, mėgintuvėlio laikiklio, kalio permanganato miltelių, degiklio, medinio pagaliuko.
Pastaba. Būtinai mūvėkite pirštines ir dėvėkite apsauginius akinius.
Darbo eiga:
- Į mėgintuvėlį įberkite kalio permanganato miltelių.
- Įtvirtinkite mėgintuvėlį laikiklyje.
- Uždekite degiklį ir kaskart jį judindami atsargiai kaitinkite mėgintuvėlį.
- Uždekite medinį pagaliuką ir jį užpūskite.
- Įkiškite rusenantį medinio pagaliuko galą į mėgintuvėlį.
- Stebėkite, kaip pagaliukas ima ryškiau šviesti ir užsiliepsnoja (2.4.4 pav.).
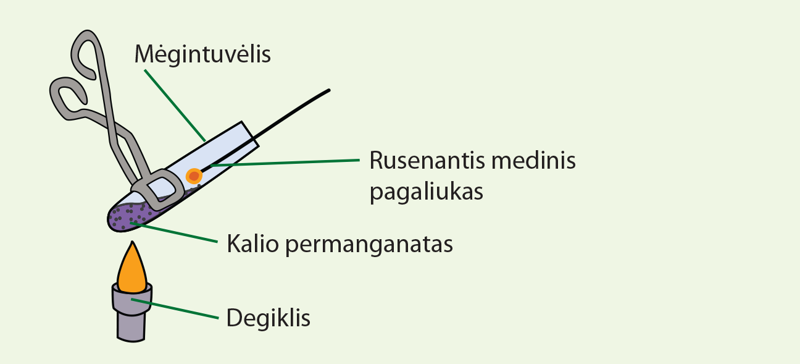
- Jei prie išsiskiriančių dujų prikištas medinis pagaliukas užsiliepsnoja, vadinasi, šios dujos yra deguonis.
Oksidai
Degant medžiagoms susidaro elementų junginių su deguonimi. Kaip jau minėta, su deguonimi jungiasi įvairios medžiagos. Gerai dega ne tik anglis, bet ir siera. Ypač daug sieros išskiria ugnikalniai, dėl to susidaro troškių nuodingųjų dujų. Ore, ypač gryname deguonyje, dega daugelis metalų (2.4.5 pav.).

Metalai dažnai dega tik stipriai įkaitinti. Gauti junginiai yra tų metalų oksidai. Pavyzdžiui, sudegus geležiai, gaunamos rūdys – geležies oksidas.
Neseniai aptarta geležies korozija ir geležies degimas yra skirtingi procesai, nors susidaro rūdžių. Geležies degimas vyksta esant aukštai temperatūrai ir yra greitas procesas, galintis sukelti staigų šilumos išsiskyrimą. Korozija, priešingai, vyksta lėtai ir gali užtrukti ilgai, kol geležies struktūra laipsniškai sunaikinama. Be to, korozija dažniausiai vyksta esant drėgnoms ar rūgščioms sąlygoms, o degimas yra susijęs su deguonimi ir aukšta temperatūra.
Oksidai – cheminių elementų junginiai su deguonimi.

Deginant šaltąsias ugneles ir fejerverkus sudega metalai magnis ir aliuminis, atsiranda daug kibirkščių ir baltų šių metalų oksidų dūmų (2.4.6 pav.).
Anglies dioksidas ir jo keliami pavojai
Degant anglies turinčioms medžiagoms ore susidaro anglies dioksidas. Anglies cheminis simbolis yra C, deguonies – O. Gautas degimo produktas yra anglies dioksidas (CO2). Vadinasi, anglies dioksido molekulėje vienam anglies atomui tenka du deguonies atomai.
Anglies dioksidas susidaro ne tik iš iškastų anglių, bet ir iš kitų medžiagų, kuriose yra anglies. Tokios yra organinės medžiagos (tai yra medžiagos, kurių pagrindinis elementas yra anglis): mediena, nafta ir naftos produktai (benzinas, dyzelinas, reaktyviniai degalai, suskystintosios dujos), gamtinės dujos ir daugelis kitų. Taigi deginant lapus, sudžiūvusias šakas, degant miškams, veikiant automobilių vidaus degimo varikliams, skraidant lėktuvams, veikiant pramonei susidaro anglies dioksidas. Ypač daug jo išsiskiria veikiant šiluminėms elektrinėms, kurios kūrenamos anglimis arba dujomis. Kasmet dėl deginamo kuro į Žemės atmosferą patenka tūkstančiai milijardų tonų anglies dioksido. Per pastarąjį šimtmetį šis skaičius išaugo dešimt kartų (2.4.7 pav.).
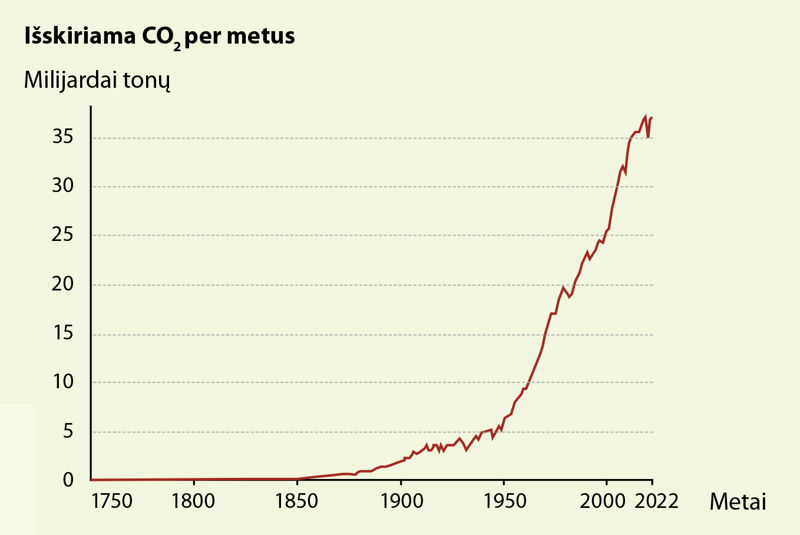
Anglies dioksido kiekio didėjimas vadinamas anglies pėdsaku. Kiekvienas mūsų, jei elgiamės neatsakingai, paliekame anglies pėdsaką. Todėl ne tik pramonė, transporto priemonės, bet ir mūsų elgesys gamtoje gali sumažinti anglies pėdsaką. Pavyzdžiui, užuot nedidelį atstumą važiavę automobiliu, galime nueiti pėsčiomis ar nuvažiuoti dviračiu. Perdžiūvusius pernykščius lapus geriau ne sudeginti, o paversti kompostu – puikia trąša.
Anglies dioksidas yra labai pavojingas. Saulės spinduliai šildo Žemę. Perteklinė šiluma gali būti išspinduliuojama atgal į kosmosą. Atmosferoje susikaupęs anglies dioksidas sugeria šilumos spindulius, todėl Žemės atmosfera po truputį šyla. Tai vadinamasis šiltnamio efèktas (2.4.8 pav.).
Anglies dioksido kiekio didėjimas atmosferoje sukelia šiltnamio efektą.
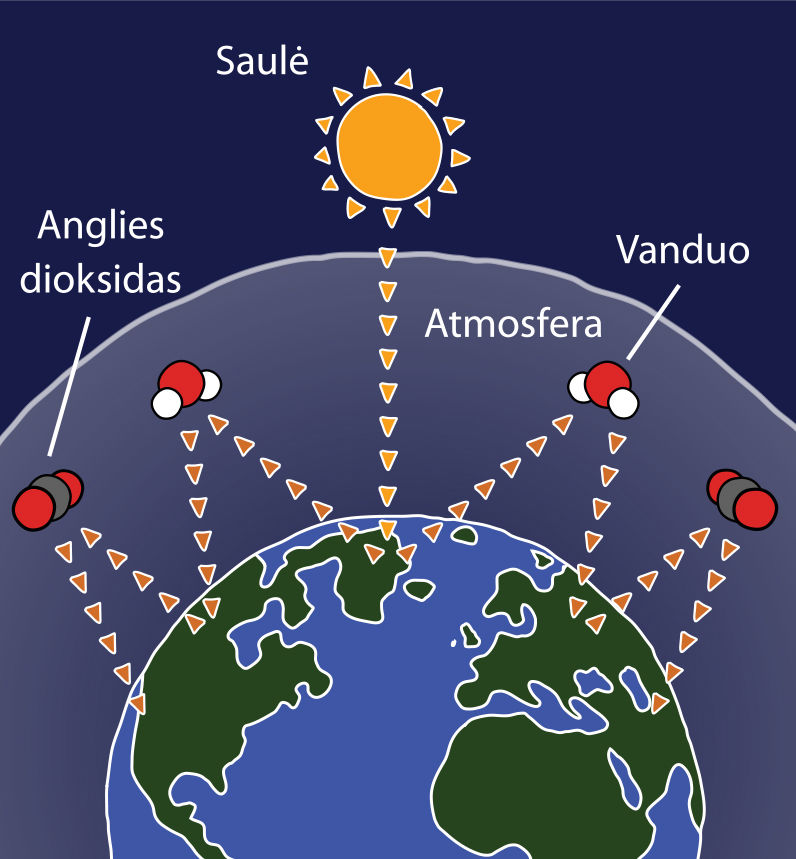
Tokiu pat efektu pasižymi atmosferos vandens garai ir išsiskyrusios gamtinės dujos. Gamtinės dujos susidaro pūvant dumblui, jas išskiria gyvūnai. Dėl šiltnamio efekto ir šiltėjančio klimato šyla vandenynai, tirpsta ledynai, kyla vandens lygis vandenynuose, taigi kai kurios šalys netrukus gali atsidurti po vandeniu. Mūsų klimatas kinta: didėja uraganų, viesulų, kitų pavojingų gamtos reiškinių tikimybė. Todėl pasaulio mokslininkai ir politikai diskutuoja, ką daryti, kad Žemės atmosfera taip greitai nešiltų. Reikia ne tik mažiau deginti organinio kuro, bet ir taip sparčiai nebekirsti miškų, didinti jų plotus. Jau minėta, kad augalai šviesoje sugeria anglies dioksidą ir gamina gyvybei būtiną deguonį.
Kitas būdas – naudoti elektrą, gaminamą ne iš kuro, o iš atsinaujinančių energijos šaltinių: saulės, vėjo, vandens. Šildymui galima naudoti biokurą, pagamintą iš medienos atliekų. Mediena – atsinaujinantis energijos šaltinis, nes medžiai naudoja saulės energiją. Taigi deginant biokurą anglies dioksido išsiskirs panašiai tiek, kiek jo buvo sunaudota per fotosintezę. Vis dėlto naudojant medieną keičiasi ekosistemos, mažėja biologinė įvairovė, todėl tai daryti vertėtų atsakingai.
Pažiūrėkite filmukus, kaip susidaro šiltnamio efektas.
Tai įdomu!
Vandenilio peroksido tirpalas naudojamas žaizdoms dezinfekuoti. Įsipjovus ar kitaip susižeidus, ant kraujuojančios žaizdos užpilama peroksido tirpalo. Susilietęs su krauju, peroksidas suskyla ir išsiskyręs deguonis sunaikina į žaizdą patekusius mikroorganizmus. Telieka aprišti žaizdą, sustabdyti kraujavimą ir leisti žaizdai gyti.
Klausimai ir užduotys
- Paaiškinkite, ką vadiname degimu. Kaip medžiagų degimas vyksta atmosferoje, kurioje nėra deguonies, pavyzdžiui, kitose planetose?
- Nurodykite, kuriai klasei priskiriamos medžiagos, susidarančios deginant sierą, geležį ir aliuminį.
- Paaiškinkite, kodėl gryname deguonyje medžiagos dega daug geriau nei ore. Aiškindami remkitės oro sudėtimi.
- Kaip būtų galima sumažinti anglies dioksido išsiskyrimą į atmosferą? Kokius anglies dioksido išmetimo mažinimo būdus taiko jūsų šeima?
- Atlikite eksperimentinį darbą „Anglies dioksido pasigaminimas ir jo naudojimas liepsnai gesinti“.
Eksperimentinis darbas „Anglies dioksido pasigaminimas ir jo naudojimas liepsnai gesinti“
Darbo tikslas: iš sodos ir acto pasigaminti anglies dioksidą ir juo užgesinti žvakės liepsną.
Hipotezė: anglies dioksidas, gaunamas iš sodos ir acto, gali būti naudojamas liepsnai užgesinti.
Jums reikės: valgomosios sodos, 9 % acto tirpalo (galima praskiesti vandeniu), aliuminio folijos, plastikinio buteliuko su pragręžtu kamšteliu, šiaudelio, žvakės, degtukų.
Darbo eiga:
- Iš aliuminio folijos pasigaminkite nedidelį mėgintuvėlį, kaip parodyta 2.4.9 paveiksle. Foliją apsukite aplink pirštą ir užspauskite vieną vamzdelio galą. Mėgintuvėlis turi būti tokio skersmens, kad tilptų į buteliuką.

- Į pasigamintą mėgintuvėlį įberkite sodos.
- Atsargiai dugnu į apačią įkiškite mėgintuvėlį į buteliuką, saugodami, kad soda neišbyrėtų.
- Į pragręžtą kamštelį įkiškite šiaudelį.
- Į buteliuką atsargiai įpilkite praskiesto acto tirpalo.
- Užsukite kamštelį su šiaudeliu (2.4.9 pav.).
- Uždekite žvakę.
- Paverskite buteliuką taip, kad soda susiliestų su actu.
- Šiaudelį nukreipkite į žvakės liepsną.
- Atsakykite į klausimus:
- Kokios dujos susidaro veikiant sodai ir actui?
- Kodėl užgeso žvakės liepsna?
- Kokių žinote kitų liepsnos gesinimo būdų?
- Paprastai žvakė gesinama užpučiant liepsną. Kas nutiktų, jei didesnę liepsną gesintume pūsdami orą?
Ko išmokome?
- Degimas yra cheminis medžiagų kitimas: medžiagos jungiasi su deguonimi, išsiskiria šiluma ir šviesa, susidaro naujų junginių. Degti gali tiek organinės (įvairios gyvūninės ar augalinės), tiek neorganinės (iš žemės iškastos arba iš mineralų pagamintos) medžiagos.
- Oksidai – dviejų cheminių elementų junginiai, iš kurių vienas yra deguonis.
- Degant anglims ir anglių turinčioms medžiagoms susidaro anglies dioksidas.
- Anglies dioksido kiekio didėjimas atmosferoje sukelia šiltnamio efektą.

