Santrauka
Nemetalų atomai atima elektronus iš metalų atomų. Taip susidaro jonai. Joninis ryšys – tai trauka tarp teigiamųjų ir neigiamųjų jonų.
Periodinės lentelės 1–2 ir 13–17 grupių elementai sudaro jonus, kurių elektronų konfigūracija sutampa su inertinių dujų atomų elektronų konfigūracija.
Periodinės lentelės 3–12 grupių elementai (pereinamieji elementai) sudaro jonus, kurių elektroninė sandara dažniausiai nesutampa su inertinių dujų atomų elektronine sandara.
Trauka tarp skirtingo krūvio ir stūma tarp vienodo krūvio jonų lemia tvarkingos struktūros – joninio kristalo – susidarymą.
Jungiantis nemetalų atomams, susidaro kovalentinis ryšys.
Kovalentiniai ryšiai būna: poliniai ir nepoliniai; viengubieji, dvigubieji ir trigubieji; sigma (σ) ir pi (π) tipo.
Atomo gebėjimą prisitraukti kito atomo elektronus rodo elektrinis neigiamumas.
Kovalentinis ryšys yra nepolinis, jei susijungiančių nemetalų elektrinis neigiamumas vienodas arba skiriasi ne daugiau kaip 0,4; polinis, jei elektrinio neigiamumo skirtumas didesnis nei 0,4.
Esant poliniam kovalentiniam ryšiui, didesnio elektrinio neigiamumo atomas įgyja dalinį neigiamąjį (δ–) krūvį, o kitas atomas įgyja dalinį teigiamąjį (δ+) krūvį.
Kuo susijungusių atomų elektrinio neigiamumo skirtumas didesnis, tuo poliškesnis tarp jų ryšys.
Polinių ryšių turinti molekulė būna nepolinė, jei dėl geometrinės formos ryšiai atsveria vienas kito poliškumą.
Nėra aiškaus elektrinio neigiamumo skirtumo, kuriam esant ryšys yra joninis. Ar medžiagoje yra joninių ryšių, galima spręsti iš jos sudėties (joninis ryšys susidaro jungiantis metalui su nemetalu) ir fizikinių savybių (santykinai aukštos lydymosi temperatūros, laidumo elektros srovei; žr. 3.2 lentelę).
Sigma (σ) tipo kovalentinis ryšys susidaro, kai orbitalės susijungia galais branduolius jungiančioje linijoje.
Pi (π) tipo kovalentinis ryšys susidaro, kai orbitalės susijungia šonais abipus branduolius jungiančios linijos.
Atomams susijungus kovalentiniais ryšiais, gali susidaryti molekulės (pavyzdžiui, CO2) arba didelį atomų skaičių jungiantys kovalentiniai trimačiai tinklai (pavyzdžiui, deimantas).
Molekulės viena kitą traukia silpnais tarpmolekuliniais ryšiais. Silpniausia sąveika susijusi su trauka tarp vienos molekulės branduolių ir kitos molekulės elektronų. Ši trauka priklauso nuo molekulės masės (didesnės masės molekulės traukia viena kitą stipriau) ir geometrinės formos (pailgos molekulės viena kitą traukia stipriau, rutulinės – silpniau).
Polinių molekulių tarpusavio trauka stipresnė nei nepolinių.
Stipriausias tarpmolekulinis ryšys yra vandenilinis. Jis gali susidaryti, jei vienoje molekulėje vandenilis sujungtas su fluoru, deguonimi arba azotu, o kitoje molekulėje yra laisvąją elektronų porą turintis fluoro, deguonies arba azoto atomas.
Kartais vandenilinis ryšys gali susidaryti tarp tos pačios molekulės skirtingų dalių. Taip vandeniliniai ryšiai susidaro baltymuose.
Praktinė užduotis
Trauka tarp vandens molekulių
Reikės
Monetos (pavyzdžiui, 2 eurocentų), pipetės, vandens, popierinio rankšluosčio, geriamosios sodos, vatos.
Atlikdami tyrimą lašinsite vandenį ant monetos ir skaičiuosite, kiek lašų reikia, kad vanduo nutekėtų nuo monetos. Prieš pradėdami spėkite, kiek tam reikės sulašinti lašų. Vėliau apskaičiuosite savo spėjimo absoliučiąją ir santykinę paklaidą.
Tyrimo žingsniai
- Monetos paviršių patrinkite kuokštu sudrėkintos ir į geriamąją sodą padažytos vatos. Taip pašalinsite riebalų apnašas. Tada monetą suimkite už briaunų ir gerai nuplaukite tekančio vandens srove. Padėkite monetą ant popierinio rankšluosčio skiautės ir sausai nušluostykite. Nelieskite monetos paviršiaus pirštais, nes jie palieka riebaluotų dėmių.
- Laikydami pipetę šiek tiek virš monetos centro, lašinkite vandenį ir skaičiuokite lašus (1 pav.). Naują lašą lašinkite tik tada, kai ant monetos esantis vanduo nebejuda. Pipetę laikykite kuo arčiau monetos paviršiaus, bet taip, kad ji neliestų vandens. Po kiekvieno lašo pažiūrėkite, kaip skystis pasiskirsto monetos paviršiuje, kokią formą įgyja besikaupiantis vanduo. Lašinkite tol, kol vanduo nebesilaikys ir nutekės. Užsirašykite, kiek lašų prireikė, kad vanduo nutekėtų. Įsidėmėkite, kaip žiūrint iš šono atrodė moneta prieš pat nutekant vandeniui.
- Pakartokite bandymą dar bent du kartus.

Duomenų analizė
- Apskaičiuokite:
- kiek vidutiniškai lašų prireikė, kad vanduo nutekėtų;
- savo spėjimo absoliučiąją ir santykinę paklaidą.
- Nupieškite, kaip žiūrint iš šono atrodė moneta prieš nutekant vandeniui. Ar vandens sluoksnis neprimena kupolo? Susiekite tokio kupolo susidarymą su vandens molekulių tarpusavio trauka. Paaiškinkite, kokiu būdu vandens molekulės traukia viena kitą.
- Vandeniui ir kitiems skysčiams būdinga paviršiaus įtemptis, susidaranti dėl molekulių tarpusavio traukos. Dėl šios įtempties vandeniniai čiuožikai gali bėgioti vandens paviršiumi (2 pav.). Nupieškite, kaip atrodo molekulių tarpusavio traukos jėgos, ir pa lyginkite, kuo skiriasi skysčio gilumoje ir skysčio paviršiuje esančių molekulių sąveika. Kaip tai susiję su paviršiaus įtemptimi?
- Esant galimybei pakartokite tyrimą su kitais skysčiais (pavyzdžiui, 2-propanoliu, acetonu, aliejumi, muiluotu vandeniu) ir apsvarstykite pastebėtus skirtumus.

Papildomos užduotys
- Kalcio fluoridas CaF2 yra joninis junginys. Apskaičiuokite, koks yra bendras visų jonų, esančių 13 mg masės kalcio fluorido kristale, skaičius.
- Koks cheminis ryšys pavaizduotas paveiksle? Remdamiesi paveikslu trimis–penkiais sakiniais pakomentuokite, kaip veikia šis ryšys.
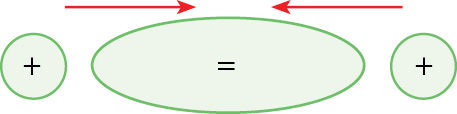
- Cheminis ryšys – tai trauka tarp dalelių. Tarp kokių dalelių pasireiškia trauka, susidarius kiekvienam iš nurodytų ryšių:
- metališkajam;
- joniniam;
- kovalentiniam;
- tarpmolekuliniam.
- Toliau pateiktoje lentelėje rasite duomenis apie metaną, metanolį ir metilmetanoatą. Paaiškinkite šiuos medžiagų savybių skirtumus:
- virimo temperatūros;
- tirpumo vandenyje.
1 lentelė. Trijų junginių savybės
Medžiaga | Lydymosi temperatūra, °C | Virimo temperatūra, °C | Tirpumas 20 °C temperatūros vandenyje |
Metanas CH4 | –182 | –162 | Apie 22 mg/l |
Metanolis CH3OH | –98 | +65 | Begalinio tirpumo |
Metilmetanoatas HCOOCH3 | –98 | +57 | Apie 40 g/l |
- Kokios agregatinės būsenos yra metilmetanoatas nurodytoje temperatūroje (naudokitės 1-ąja lentele)?
- –95 °C;
- +50 °C;
- –100 °C;
- +80 °C.
- Kokie tarpmolekuliniai ryšiai pasireiškia:
- gryname skystame metilmetanoate;
- metilmetanoato vandeniniame tirpale?
- Kurios iš nurodytų medžiagų virimo temperatūra žemiausia? Atsakymą paaiškinkite.
- CsF
- HF
- CaSO4
- SiO2
- Kuriuo atveju medžiaga nelaidi elektros srovei?
- Kietosios būsenos gyvsidabris
- Išlydytas gyvsidabris
- Kietosios būsenos kalio chloridas
- Išlydytas kalio chloridas
- Kurios iš medžiagų tirpumas vandenyje didžiausias? Atsakymą paaiškinkite.
- Cl–CH2–CH2–CH2–CH2–Cl
- CH3–CH2–CH2–CH2–OH
- CH3–CH2–CH2–CH3
- HO–CH2–CH2–CH2–CH2–OH
- CH3–CH2–O–CH2–CH3
- Virtuvės viryklės kaitros pakanka išlydyti cukrui, bet nepakanka išlydyti valgomajai druskai. Kodėl?
- Nes joniniai ryšiai tvirtesni už kovalentinius.
- Nes kovalentiniai ryšiai tvirtesni už joninius.
- Nes cukrus yra organinis, o valgomoji druska – neorganinis junginys.
- Nes valgomosios druskos lydymas susijęs su joninių ryšių nutraukimu, o lydant cukrų nutraukiami tik tarpmolekuliniai ryšiai, kovalentiniai ryšiai išlieka.

- Fulerenai yra vien iš anglies sudarytos rutulinės molekulės (4 pav.). Žinomi fulerenai C60, C70, C80, C240.
- Kaip vadinamos tik iš vieno elemento atomų sudarytos medžiagos?
- Kokių dar žinote vien iš anglies sudarytų medžiagų? Nurodykite ryšius fulerene ir kitose vien iš anglies atomų sudarytose medžiagose.
- Fulereno C60 lydymosi temperatūra 280 °C. Kokia yra kitų vien iš anglies atomų sudarytų medžiagų lydymosi temperatūra – aukštesnė ar žemesnė už fulereno? Kodėl?
- Laikotarpis maždaug nuo 3300 iki 1200 m. prieš mūsų erą vadinamas bronzos amžiumi. Tada pagrindinė įrankiams ir ginklams gaminti naudota medžiaga buvo bronza – vario ir alavo lydinys. Apie 1200 m. pr. m. e. bronzą pakeitė geležies lydiniai. Bronzos procentinė sudėtis gali šiek tiek įvairuoti. Tarkime, turime mėginį bronzos, kurioje vario masės dalis 88,23 %. Likusioji dalis – alavas. Koks yra vario ir alavo atomų skaičiaus santykis šiame mėginyje? Atsakymą išreikškite dviejų mažiausių sveikųjų skaičių santykiu.
- Elektros srovė – tai kryptingas krūvį turinčių dalelių judėjimas. Kokios dalelės juda, kai elektros srovė teka:
- metalu;
- natrio chlorido tirpalu;
- išlydytu natrio chloridu?
- Plienas yra geležies ir anglies lydinys. Specialiosios paskirties plienas gali turėti ir kitų elementų. Turime mėginį plieno, kuriame anglies masės dalis 1,5 %. Likusi masės dalis yra geležies. Mėginyje yra 1,81 · 1024 anglies atomų. Kokia yra plieno mėginio masė?
- Lentelėje nurodytos volframo W, aliuminio oksido Al2O3, oktadekano C18H38 ir silicio dioksido SiO2 savybės. Vietoj medžiagų formulių lentelėje parašytos raidės. Naudodamiesi tik šioje lentelėje pateikta informacija, nuspręskite, kuria raide kuri medžiaga pažymėta. Remdamiesi žiniomis apie cheminius ryšius, paaiškinkite, kas lemia lentelėje nurodytas šių medžiagų savybes.
Medžiaga | Lydymosi temperatūra, °C | Laidumas elektros srovei, kai medžiaga yra kietosios būsenos | Laidumas elektros srovei, kai medžiaga yra išlydyta |
A | 45 | Nelaidi | Nelaidi |
B | 3422 | Laidi | Laidi |
C | 1713 | Nelaidi | Nelaidi |
D | 2072 | Nelaidi | Laidi |

