Oksidãcijos láipsnis, molèkulė, formulinis vienetas, jònas, vieninė medžiagà, dvinãris junginỹs, oksidãcijos láipsnio apskaičiãvimo taisỹklės.
Ką rodo oksidacijos laipsnis?
Jungiantis atomams pakinta jų elektroninė sandara. Atomai gali netekti arba prisijungti papildomai elektronų (susidaro joniniai ryšiai) arba elektronai gali tik iš dalies pasislinkti nuo vieno atomo prie kito (susidaro kovalentiniai ryšiai). Galutiniam elektronų persigrupavimo rezultatui įvertinti patogi oksidãcijos láipsnio sąvoka.
Jeigu atomas įgyja papildomą elektroną arba tik patraukia vieną elektroną į savo pusę, jam priskiriamas oksidacijos laipsnis –1. Atitinkamai, jei elektronų persigrupuoja daugiau, oksidacijos laipsnis bus išreikštas didesniu skaičiumi. Kai atomas netenka elektronų arba jo elektronai tik atitraukiami, jam priskiriamas teigiamasis oksidacijos laipsnis. Jei atomas iš tiesų virsta jonu, jo realus krūvis ir oksidacijos laipsnis sutampa. Jeigu susidaro polinis kovalentinis ryšys, oksidacijos laipsnis rodo tik pasislinkusių atomo link arba nuo jo nutolusių elektronų skaičių. Taip skaičiuojant nepaisoma skirtumo tarp joninių ir kovalentinių medžiagų. Oksidacijos laipsniai skaičiuojami vienodai. Realų jono krūvį nurodome pirmà rašydami skaičių, tada ženklą (pvz., S2–), o oksidacijos laipsnį – pirma ženklą, tada skaičių (pvz., S–2). Pagal IUPAC taisykles oksidacijos laipsnis žymimas romėnų skaitmeniu. Mes taip žymėsime tik rašydami pavadinimus, pavyzdžiui, anglies(IV) oksido pavadinime skaičiumi IV nurodytas anglies oksidacijos laipsnis.
4.2 lentelė. Oksidacijos laipsnio apskaičiavimo taisyklės
Nr. | Taisyklė | Pavyzdžiai ir galimos išimtys |
1 | Vieninėse medžiagose atomų OL lygūs nuliui. | ; |
2 | Molekulę ar formulinį vienetą sudarančių atomų OL suma lygi nuliui. Joną sudarančių atomų OL suma lygi jono krūviui. | SO3 OL suma lygi 0; |
3 | 1-osios grupės metalų OL = +1. | Na+1Cl |
4 | Vandenilio OL = +1. | H+1NO3, NaF–1 |
5 | Deguonies OL = –2. | CaO–2 |
6 | Dvinariuose (iš dviejų elementų sudarytuose) junginiuose: | N–3H3 |
Oksidacijos laipsnio apskaičiavimo taisyklės
4.2 lentelėje prioriteto mažėjimo tvarka pateiktos oksidãcijos láipsnio apskaičiãvimo taisỹklės. Kad būtų trumpiau, frazė „oksidacijos laipsnis“ trumpinama OL. Jeigu kelios taisyklės prieštarauja viena kitai, laikomasi taisyklės, kuri šiame sąraše yra pirmesnė. Kitų elementų, kurių oksidacijos laipsniai taisyklėse neaptarti, apskaičiuojami kaip pateikta pavyzdžiuose.
1 pavyzdys
Apskaičiuokite kiekvieno elemento oksidacijos laipsnį nurodytuose junginiuose:
- sieros rūgštyje H2SO4;
- kalio dichromate K2Cr2O7;
- metanalyje HCHO.
Sprendimas
- Vandenilio ir deguonies oksidacijos laipsniai nurodyti taisyklėse (4.2 lentelė). Sieros oksidacijos laipsnį pažymime x. Visų molekulę sudarančių atomų oksidacijos laipsnių suma turi būti lygi nuliui. Sudarome lygtį. Spalvomis pažymėta, kurio elemento koks oksidacijos laipsnis.
H2SO4
2 · (+1) + x + 4 · (–2) = 0;
x = +6.
Atsakymas:
- Kalio ir deguonies oksidacijos laipsniai nurodyti taisyklėse (4.2 lentelė). Chromo oksidacijos laipsnį pažymime x. Chromo atomai yra du, tad lygtyje naudosime 2x. Visų formulinį vienetą sudarančių atomų oksidacijos laipsnių suma turi būti lygi nuliui. Sudarome lygtį.
K2Cr2O7
2 · (+1) + 2x + 7 · (–2) = 0;
x = +6.
Atsakymas:
- Vandenilio ir deguonies oksidacijos laipsniai nurodyti taisyklėse (4.2 lentelė). Anglies oksidacijos laipsnį pažymime x. Visų molekulę sudarančių atomų oksidacijos laipsnių suma turi būti lygi nuliui. Sudarome lygtį.
HCHO
(+1) + x + (+1) + (–2) = 0;
x = 0.
Atsakymas: H+1C0H+1O–2.
Komentaras. Nulinis oksidacijos laipsnis junginyje gali pasirodyti keistas. Kodėl jis toks, paaiškinta 4.2.1 paveiksle.
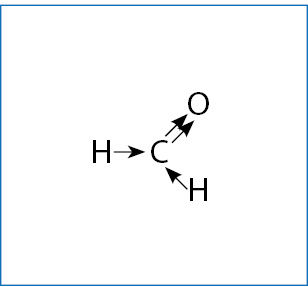
2 pavyzdys
Apskaičiuokite kiekvieno elemento oksidacijos laipsnį nurodytuose jonuose:
NO 3 - S 2 O 3 2 -
Sprendimas
- Azoto oksidacijos laipsnį pažymime x. Visų joną sudarančių atomų oksidacijos laipsnių suma turi būti lygi jono krūviui, šiuo atveju –1. Sudarome lygtį.
x + 3 · (–2) = –1;
x = +5.
Atsakymas:
- Sieros oksidacijos laipsnį pažymime x. Sieros atomai yra du, tad lygtyje naudosime 2x. Visų joną sudarančių atomų oksidacijos laipsnių suma turi būti lygi jono krūviui. Sudarome lygtį.
2x + 3 · (–2) = –2;
x = +2.
Atsakymas:
3 pavyzdys
Apskaičiuokite kiekvieno elemento oksidacijos laipsnį:
- Fe3O4;
- (NH4)2C2O4.
Sprendimas
- Fe3O4
3x + 4 · (–2) = 0;
x = +
Atsakymas:
Komentaras. Trupmeninį oksidacijos laipsnį gavome todėl, kad joniniame kristale Fe3O4 yra dvejopų geležies jonų, vienų oksidacijos laipsnis yra +2, kitų +3. Pirmųjų yra dvigubai daugiau nei antrųjų. Skirtingi jonai užima skirtingas joninio kristalo vietas. Skaičiuodami įprastu būdu gavome geležies oksidacijos laipsnių svertinį vidurkį. Kartais šio junginio formulė rašoma FeO · Fe2O3. Toks užrašas tiksliau nurodo, kokių jonų realiai yra junginyje.
- Šiame junginyje net du elementai – azotas ir anglis – yra kintamojo oksidacijos laipsnio, todėl spręsdami nagrinėsime jonus, iš kurių ši medžiaga sudaryta. Lengviausia iš formulės atpažinti amonio joną
N H 4 +
x + 4 · (+1) = +1;
x = –3.
Neigiamasis jonas turi krūvį 2–, nes yra susijungęs su dviem
2y + 4 · (–2) = –2;
y = +3.
Atsakymas:
Klausimai ir užduotys
- Paaiškinkite, ką rodo oksidacijos laipsnis, jeigu junginyje nėra jonų (visi ryšiai tik kovalentiniai poliniai).
- Kai kuriuose junginiuose formaliai apskaičiuotas oksidacijos laipsnis būna trupmeninis. Paaiškinkite, kodėl.
- Nurodykite kiekvieno elemento oksidacijos laipsnį:
- SO3;
- SO2;
- H2S.
- Nurodykite kiekvieno elemento oksidacijos laipsnį:
- N2O5;
- HNO3;
- NaNO3.
- Nurodykite kiekvieno elemento oksidacijos laipsnį:
- FePO4;
- Fe3(PO4)2;
- Ca(ClO)2;
- NH4NO3;
- Ca3(AsO4)2.
- Nurodykite kiekvieno joną sudarančio elemento oksidacijos laipsnį:
ClO 4 - SO 3 2 - P 2 O 7 4 -
- Apskaičiuokite anglies oksidacijos laipsnį gliukozės C6H12O6 ir propano molekulėse. Sudarykite šių molekulių struktūrines formules ir paaiškinkite gautas anglies oksidacijos laipsnio skaitines vertes.
