Cheminis ryšys
Susidarant cheminiams junginiams atomai ar iš jų gautos dalelės susijungia tam tikra sąveika. Ši sąveika vadinama cheminiu ryšiu.
Chèminiu ryšiù vadinama dalelių tarpusavio sąveika, lemianti jonų, molekulių, kristalų susidarymą.
Pagal savo prigimtį cheminiai ryšiai gali būti skirstomi į pòlinius ir nepòlinius.
Joninis ryšys
Puikus polinio cheminio ryšio pavyzdys yra joninis ryšys. Jau žinote, kad, sąveikaujantiems atomams netenkant elektronų arba juos prisijungiant, susidaro krūvį turinčios dalelės – jonai, tarp kurių atsiranda elektrostatinė sąveika (pliusas traukia minusą), arba joninis ryšys. Toks ryšys susidaro jungiantis metalui su nemetalu, pavyzdžiui, natriui su chloru.
Veikiami elektrostatinių jėgų, jonai traukia vienas kitą ir sudaro jòninius jùnginius – kietas kristalines medžiagas.
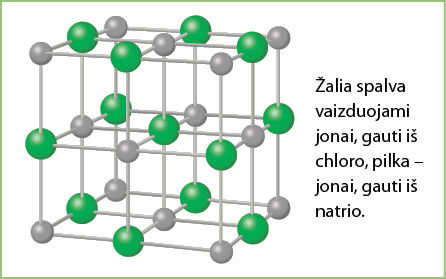
Joninis ryšys susiformuoja tarp natrio ir chlorido jonų, kurie išsidėsto erdvėje sudarydami kubo formos kristalus (3.2.1 pav.). Kubo formos druskos kristalus galime stebėti pro mikroskopą (3.2.2 pav.).
Ne visi joniniai junginiai sudaro kubo formos kristalus. Kristalų forma gali labai skirtis, tačiau visų jų bendra savybė yra ta, kad teigiamieji jonai sąveikauja su neigiamaisiais jonais. Primename, kad jonai susidaro tada, kai atomo, kuriam būdingas mažesnis elektrinis neigiamumas, elektronus prisijungia kitas, didesnio elektrinio neigiamumo, atomas.
Kovalentinis ryšys
Sąveikaudami tarpusavyje elementų atomai kartais ne atiduoda ar prisijungia elektronus, o jais dalijasi. Tai būdinga kitam cheminių ryšių tipui – kovalentiniam. Paprastai kovalentiniu ryšiu tarpusavyje jungiasi nemetalai.
Jungdamiesi kovaleñtiniu ryšiù elementai dalijasi išorinio sluoksnio elektronais – sudaro bendras elektronų poras. Tai energiškai naudinga.
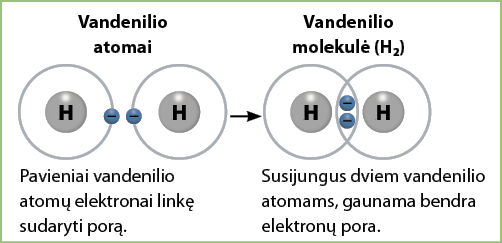
Pavyzdžiui, du vandenilio atomai jungiasi tarpusavyje ir sudaro vandenilio junginį iš dviejų vandenilio atomų – vandenilio molekulę. Joje iki tol buvę pavieniai vandenilio atomų elektronai sudaro bendrą elektronų porą (3.2.3 pav.).
Kovalentinis ryšys gali būti dvejopas – polinis ir nepolinis. Išsiaiškinkime, kuo skiriasi šie ryšiai.
Kovaleñtinis pòlinis ryšys. Šiuo atveju elemento, kurio elektrinis neigiamumas yra didesnis, atomas pritraukia bendrus elektronus savęs link, bet jų visiškai nepasiima. Susidaro poliniai junginiai.
Kovaleñtinis nepòlinis ryšys. Šiuo ryšiu susieti junginiai susidaro tarp elementų, kurių elektrinis neigiamumas yra vienodas arba beveik nesiskiria. Abiejų elementų atomai vienodai dalijasi bendra elektronų pora, jų elektronų sluoksniai tarsi susilieja. Susidaro nepoliniai junginiai.
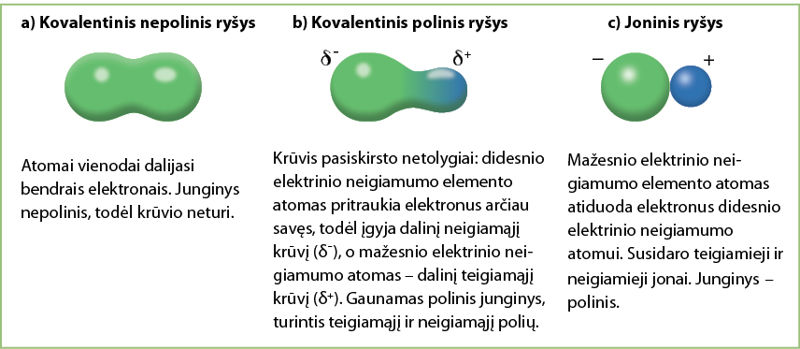
Kokį krūvį įgyja susidarę junginiai? Susidarant kovalentiniam nepoliniam ryšiui, atomai vienodai dalijasi bendrais elektronais, todėl gautas junginys krūvio neturi (3.2.4 pav., a).
Esant kovalentiniam poliniam ryšiui, bendra elektronų pora tik pasislenka arčiau atomo, kurio elektrinis neigiamumas didesnis (3.2.4 pav., b). Todėl krūvį turinčių dalelių nesusidaro. Gaunamas polinis junginys, kuriame bendrus elektronus arčiau savęs pritraukęs atomas įgyja dalinį neigiamąjį krūvį (δ-), o atomas, nuo kurio elektronai atitraukti, – dalinį teigiamąjį krūvį (δ+).
2.5 temoje nagrinėjome, kaip iš IA grupės elementų metalų gaunami teigiamieji jonai, o iš VIIA grupės nemetalų, prisijungusių elektroną, – neigiamieji jonai. Krūvį turinčių dalelių susidarymas būdingas joniniam ryšiui (3.2.4 pav., c).
Žinant cheminių elementų elektrinį neigiamumą, nesunku apskaičiuoti susijungiančių elementų elektrinio neigiamumo skirtumą ir pagal tai nustatyti cheminio ryšio tipą. Pažvelkime, kaip susiję elementų elektrinio neigiamumo skirtumas ir cheminio ryšio tipas (3.2.1 lentelė).
3.2.1 lentelė. Cheminio ryšio tipo sąsaja su elementų elektrinio neigiamumo skirtumu
Cheminio ryšio tipas | Elementų elektrinio |
Kovalentinis nepolinis ryšys | < 0,4 |
Kovalentinis polinis ryšys | Nuo 0,4 iki 1,8 |
Joninis ryšys | > 1,8 |
Panagrinėkime kelis pavyzdžius ir nustatykime ryšio tipą (3.2.2 lentelė).
3.2.2 lentelė. Kai kurių elementų elektrinio neigiamumo skirtumo palyginimas ir junginių cheminio ryšio nustatymas
Junginys | Formulė | Pirmojo elemento elektrinis neigiamumas | Antrojo elemento elektrinis neigiamumas | Skirtumas | Cheminis ryšys |
Vandenilis | H2 | 2,20 | 2,20 | 0 | Kovalentinis nepolinis |
Chloras | Cl2 | 3,16 | 3,16 | 0 | Kovalentinis nepolinis |
Vandenilio chloridas | HCl | 2,20 | 3,16 | 0,94 | Kovalentinis polinis |
Vanduo | H2O | 2,20 | 3,44 | 1,24 | Kovalentinis polinis |
Ličio chloridas | LiCl | 0,98 | 3,16 | 2,18 | Joninis |
Natrio chloridas | NaCl | 0,93 | 3,16 | 2,23 | Joninis |
Šį elementų cheminių ryšių tipų skirtumą galima pavaizduoti tokiu piešiniu (3.2.5 pav.). Paimkime chloro, vandenilio chlorido ir natrio chlorido junginius.
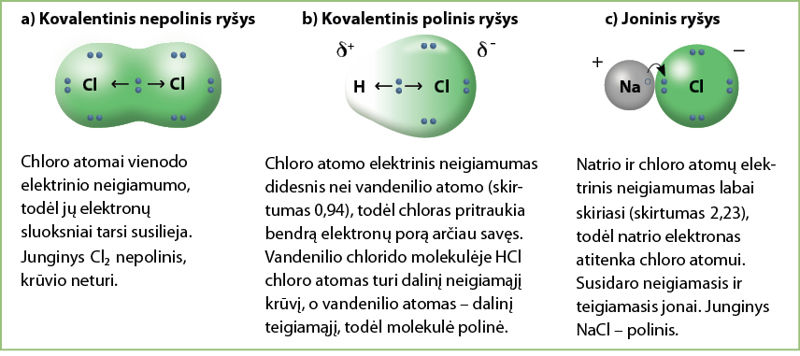
Kaip matome iš 3.2.5 paveikslo, susidarant nepoliniam ryšiui (a), bendri elektronai vienodai pasiskirsto tarp dviejų chloro atomų. Vandenilis ir chloras sujungti poliniu ryšiu (b) – chloro atomas pritraukia bendrus elektronus arčiau savęs. Natrio ir chloro dalelės susijusios joniniu ryšiu (c) – natrio elektronas visiškai pereina į chloro atomo elektronų sluoksnį.
Viengubasis ir dvigubasis ryšiai
Jau žinome, kad elementams energiškai naudinga sudaryti bendras elektronų poras. Nagrinėdami 3.2.3 paveikslą (p. 51) išsiaiškinome, kaip, dviem vandenilio atomams dalijantis viena bendra elektronų pora, susidaro vandenilio molekulė. Kadangi bendra elektronų pora viena, šis ryšys – viengubasis.
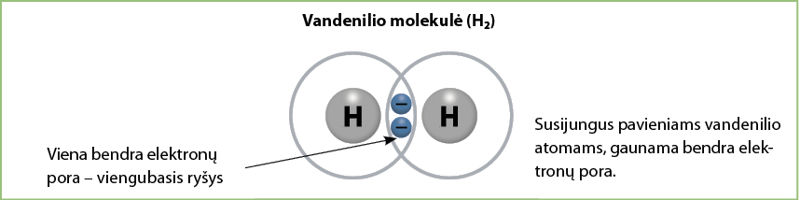
Kadangi šis junginys sudarytas iš to paties elemento – vandenilio, nėra elektrinio neigiamumo skirtumo. Susidaręs ryšys yra kovalentinis nepolinis. Šį ryšį galime pažymėti struktūrine fòrmule: H–H. Brūkšnys reiškia bendrą elektronų porą, tai yra vieną ryšį.
Tokiu pat kovalentiniu nepoliniu ryšiu tarpusavyje jungiasi du deguonies atomai. Kiekvieno deguonies atomo išoriniame elektronų sluoksnyje yra 6 elektronai: dvi elektronų poros ir du nesuporuoti elektronai. Iki užpildyto išorinio elektronų sluoksnio kiekvienam iš atomų trūksta dviejų elektronų. Todėl atomai dalijasi nesuporuotais elektronais ir suformuoja dvi bendras elektronų poras – susidaro dvigubasis ryšys. Susidarius dviem bendroms elektronų poroms, gaunama deguonies molekulė (3.2.7 pav.).
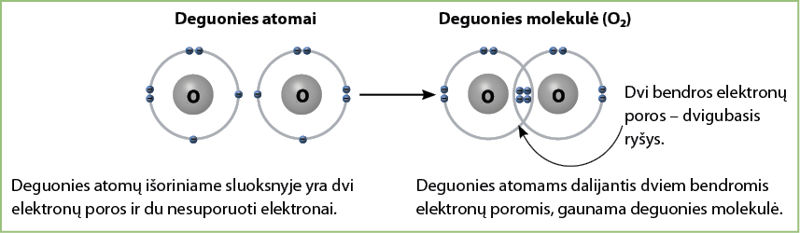
Taigi deguonies molekulės struktūrinė formulė užrašoma taip: O=O. Kiekvienas brūkšnys žymi vieną bendrą elektronų porą.
Dabar pabandykime pavaizduoti, kaip susidaro vandens molekulė. Jos formulė yra H2O. Tai reiškia, kad vienam deguonies atomui tenka du vandenilio atomai. Deguonies atomas turi du nesuporuotus elektronus. Kiekvienas vandenilio atomas turi vieną elektroną. Vadinasi, susidarant vandens molekulei, nesuporuoti deguonies elektronai sudarys du ryšius su vandenilio elektronais. Be to, deguonies atomas savo išoriniame elektronų sluoksnyje turi dvi laisvas elektronų poras. Iš viso yra 6 elektronai, iš kurių du dalyvauja susidarant ryšiui, o keturi yra laisvieji elektronai (3.2.8 pav.).
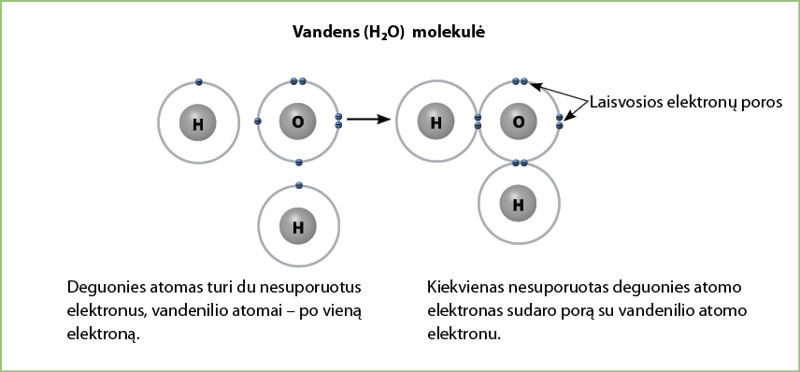
Nagrinėdami 3.1.1 lentelę sužinojote, kad deguonies elektrinis neigiamumas daug didesnis už vandenilio (skirtumas sudaro 1,22). Taigi šis ryšys yra kovalentinis polinis. Tai reiškia, kad vandens molekulė yra polinė, joje tarsi du skirtingi poliai: deguonies neigiamasis ir vandenilio teigiamasis. Taip yra dėl to, kad atomai dalijasi elektronais nevienodai. Bendri elektronai ilgiau pabūna prie didesnio elektrinio neigiamumo atomo – deguonies. Tai labai svarbi vandens savybė, dėl kurios atsiranda sąveika tarp atskirų vandens molekulių, apie kurią kalbėsime vėliau.
Vandens molekulę galima užrašyti struktūrine formule.
Klausimai ir užduotys
- Kaip susijęs elementų elektrinio neigiamumo skirtumas ir cheminio ryšio tipas? Koks junginys laikytinas joniniu?
- Paaiškinkite, kodėl vandenilio, deguonies, chloro molekulės sudarytos iš dviejų atomų. Pavaizduokite chloro molekulės struktūrinę formulę.
- Nupieškite vandenilio fluorido junginio modelį, pavaizduodami kiekvieno atomo elektronų sluoksnius. Koks yra šių elementų elektrinio neigiamumo skirtumas? Ar šis junginys laikytinas joniniu? Kodėl?
- Pavaizduokite ličio ir fluoro junginio modelį. Ar šis junginys yra joninis?
- Remdamiesi 3.1.1 lentelės duomenimis, parašykite, kurio elemento atomas kiekvienoje iš toliau išvardytų porų bus linkęs prisijungti elektronus. Nurodykite, kiek elektronų gali prisijungti elemento atomas, kad jo išorinis elektronų sluoksnis būtų užpildytas.
Palyginkite kiekvienos poros elementų elektrinio neigiamumo skirtumą ir parašykite šių junginių cheminio ryšio tipą:- litis ir deguonis;
- magnis ir chloras;
- natris ir azotas;
- vandenilis ir siera.
Ko išmokome?
- Cheminiu ryšiu vadinama dalelių tarpusavio sąveika, dėl kurios susidaro junginys.
- Kai elementų elektrinio neigiamumo skirtumas yra > 1,8, susidaro joninis ryšys; jei šis skirtumas yra nuo 0,4 iki 1,8, ryšys yra kovalentinis polinis; jei skirtumas yra < 0,4, cheminis ryšys yra kovalentinis nepolinis.
- Pagal savo prigimtį cheminiai ryšiai gali būti poliniai (joniniai ir kovalentiniai) ir nepoliniai (kovalentiniai).
- Joninis ryšys susidaro atomams atiduodant ir prisijungiant elektronus. Atiduodami ir prisijungdami elektronus atomai virsta priešingo krūvio jonais.
- Jungdamiesi kovalentiniu ryšiu elementai sudaro bendras elektronų poras.
- Elementų atomų jungimasis tarpusavyje, kai jų elektronai sudaro bendras poras, yra energiškai naudingas.
- Atomai, susijungę kovalentiniu nepoliniu ryšiu, bendra elektronų pora dalijasi vienodai. Toks nepolinis junginys krūvio neturi.
- Susidarant kovalentiniam poliniam ryšiui, bendra elektronų pora pasislenka arčiau atomo, kurio elektrinis neigiamumas didesnis, todėl krūvis pasiskirsto netolygiai. Gaunamas polinis junginys, turintis teigiamąjį ir neigiamąjį polių.
- Cheminės formulės užrašymas bendras elektronų poras vaizduojant brūkšniais vadinamas struktūrine formule.